
2、如图所示,质量为m的等边三棱柱静止在水平放置的斜面上。已知三棱柱与斜面之间的动摩擦因数为 ,斜面的倾角为
,斜面的倾角为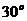 ,则斜面对三棱柱的支持力与摩擦力的大小分别为( )
,则斜面对三棱柱的支持力与摩擦力的大小分别为( )
 A.
A.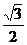 mg和
mg和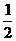 mg
B.
mg
B.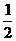 mg和
mg和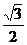 mg
mg
C.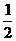 mg和
mg和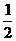
 mg D.
mg D.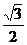 mg和
mg和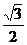
 mg
mg
1、 水平地面上有一木箱,木箱与地面之间的动摩擦因数为
水平地面上有一木箱,木箱与地面之间的动摩擦因数为 。现对木箱施加一拉力F,使木箱做匀速直线运动。设F的方向与水平面夹角为
。现对木箱施加一拉力F,使木箱做匀速直线运动。设F的方向与水平面夹角为 ,如图,在
,如图,在 从0逐渐增大到90°的过程中,木箱的速度保持不变,则 ( )
从0逐渐增大到90°的过程中,木箱的速度保持不变,则 ( )
A.F先减小后增大 B.F一直增大
C.F的功率减小 D.F的功率不变
22.(8分)在一定条件下,NanRO3和NaI在硫酸介质中反应,发生反应生成NaR、I2和Na2SO4。已知该变化过程中,0.1mol的NanRO3参加反应时共转移0.6mol电子:
(1)RO3n-中R元素的化合价是 ;
(2)R元素的最外层电子数为 ;
(3)写出该反应配平的离子方程式。
(4) KMnO4+ H2O2+ H2SO4- K2SO4+ MnSO4+ O2↑+ H2O
贵州省兴义市崇文中学2010届高三第一次月考
21、(10分)根据右边反应框图填空。
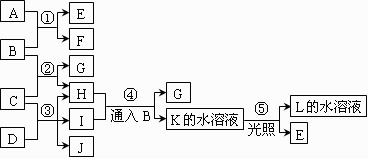
已知B、D、E、L常温下为
密度比空气大的气体,D、
E为单质,其他为化合物。
A是一种淡黄色固体,C在
水中的溶解度随温度的升高
而减小,F、G均能与L的
水溶液反应放出B。
⑴ F的俗名是 ,工业上利用反应③生产 。
⑵ 反应①~⑤中,属于氧化还原反应的是 。
⑶ 反应④的离子方程式为 。
⑷ 有一种单质能与H反应生成E,该反应的化学方程式为 。
⑸ 某气体M具有漂白作用,既有氧化性,又有还原性,请写出同时有B、H和M生成的化学方程式 。
20、(8分)科学实验和人类的生活经验告诉我们,化学反应中的物质变化和能量变化是紧密地联系在一起的。请回答以下问题:
⑴ 离子反应H+(aq)+OH-(aq)==H2O(1); △H=-57.3kJ·mol-1表示在稀溶液中,强酸和强碱反应生成1mol H2O(1),这时的反应热叫做中和热。
① 在中和热的测定实验中,下列溶液组合最合适的是_________。
A.25mL 0.4mol·L-1盐酸溶液与25mL 0.4mol·L-1氨水
B.25mL 0.4mol·L-1盐酸溶液与25mL 0.41mol·L-1NaOH溶液
C.25mL 0.4mol·L-1H2SO4溶液与25mL 0.8mol·L-1NaOH溶液
D.25mL 0.4mol·L-1H2SO4溶液与25mL 0.4mol·L-1Ba(OH)2溶液
② 举一例符合上述离子反应的非酸碱的中和反应化学方程式:
⑵ 已知CH4(g)+2O2(g) ==CO2(g)+2H2O⑴;△H =-890.3kJ·mol-1。
① 当1mol CH4(g)与2mol O2(g)的总能量之和是3048.44kJ·mol-1,则1mol CO2(g)与2mol H2O⑴总能量之和是 kJ·mol-1。
② 某家庭用天然气(主要成分是甲烷)为燃料,烧一壶开水,共需热量17.8kJ,现实际消耗4.48L天然气,则热能的利用率约为 [均按标准状况的CH4计算,热能利用率=(实际利用的热量/供给的总热量)×100%]。
19、(7分)生活饮用水水质的标准主要有:色度、浑浊度、pH、细菌总数、嗅和味等。目前城市自来水处理过程中所使用的主要试剂仍是Cl2(消毒剂)和Al2(SO4)3(沉降剂),但由于种种原因,用这两种物质处理水质,总有缺陷。有资料报道:Na2FeO4(化合物中Fe呈+6价)是一种强氧化剂,可作为一种新型净水剂,在反应中被还原为Fe3+,因此使用该物质可代替Cl2和Al2(SO4)3。
⑴ 配平工业上制备铁酸钠的化学方程式:
Fe2O3+ NaNO3+ NaOH - Na2FeO4+ NaNO2+ H2O
⑵ 以上反应中,氧化剂为 (填编号)。
a. Fe2O3 b. NaNO3 c. NaOH d. Na2FeO4 e. NaNO2
⑶ 当反应物中含有1.4 mol Na+,且上述反应恰好完全进行时,电子转移总数为 NA。
18、(12分)为了证明在实验室制备Cl2的过程中会有水蒸气和HCl挥发出来,甲同学设计了如下图所示的实验装置,按要求回答问题。


⑴ 请根据甲同学的意图,连接相应的装置,接口顺序:
b接 , 接 , 接a。
⑵ U形管中所盛试剂的化学式为 。
⑶ 装置③中CCl4的作用是 。
⑷ 乙同学认为甲同学实验中有缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液中的气体只有一种,乙同学提出在某两个装置之间再加装置⑤。你认为装置⑤应加在 之间(填装置序号)。瓶中可以放入 。
⑸ 丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成其他溶液。你认为可将溶液换成 ,如果观察到 的现象,则证明制Cl2时有HCl挥发出来。
17、(7分)化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
(1)从物质的分类角度看,不恰当的一种物质是______
(2)“三酸”与“两碱”之间均可反应,若用化学方程式表示有六个(酸过量时),若用离子方程式表示却只有两个,请写出这两个离子方程式(酸过量时)__________ ,
(3)烧碱、纯碱均可吸收CO2,当含0.1molNaOH的溶液吸收一定量CO2后,将溶液低温蒸干得到固体的组成可能有四种情况,分别是:①___________ ②___________ ③_________ ④ ___________
16、将足量CO2通入KOH和Ca(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(v)的关系正确的是
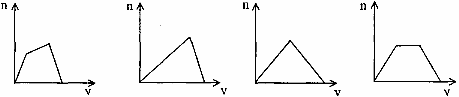
A B C D
15、纯净的碳酸氢钙试样在高温下分解,当剩余的固体物质质量为原试样质量的一半时,碳酸氢钙的分解率为
A.50% B.75% C.92.7% D.100%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com