
2.电解精炼
电解时,以 作电解液, 作阴极, 作阳极
试题枚举
[例1] 在稀硫酸中加入铜粉,铜粉不溶,再加入下列固体粉末:①FeCl2; ②Fe2O3; ③Na; ④Ca(NO3)2。铜粉可溶解的是( )
A.①② B.②④ C.②③ D.①④
解析: 加入Fe2O3反应生成Fe3+能氧化铜,加入Ca(NO3)2后等于铜和硝酸反应而消耗。
答案:B
[变式] 现有下列试剂:①食盐水 ②稀H2SO4 ③氯化铁 ④盐酸 ⑤NaOH溶液 ⑥硝酸银 ⑦硝酸钾,如将Cu转化为CuCl2,可采用的一组试剂是( )
A.④⑤⑥ B.③④⑤ C.①②③ D.④⑤⑦
[例2] 在FeCl3、CuCl2、FeCl2的混合溶液中,Fe3+、Cu2+、Fe2+的物质的量浓度之比为:4:2:1,现加入适量的铁粉,使溶液中的三种离子的物质的量浓度之比为:1:3:9,则投入的铁粉与原溶液中Cu2+的物质的量之比为( )
A.5:4 B.4:5 C.3:5 D.5:6
解析: 溶液中还存在Fe3+,说明溶液中Cu2+没有反应,加入的铁全部反应,将粒子比例调整为:12:6:3和2:6:18,若溶液中由6molCu2+,就有10molFe3+发生反应,消耗5mol铁。
答案: D
[变式]将Cu片放入0.l mol / L FeCl3溶液中,反应一定时间后取出Cu片,溶液中c(Fe3+)∶c(Fe2+)=2∶3,则Cu2+与Fe3+的物质的量之比为
A.3∶2 B.3∶5 C.4∶3 D.3∶4
[例3] 如图,盛有足量水的水槽里放两个烧杯,小烧杯里放有少量铜片和过量浓硝酸,小烧杯外面倒扣一个大烧杯,请回答:
 (1)铜与浓硝酸反应的化学方程式:_______________________;
(1)铜与浓硝酸反应的化学方程式:_______________________;
(2)实验中观察到的主要现象是:
①_______________________________ ;
②_______________________________ ;
③_______________________________ ;
④_______________________________ 。
(3)用该装置做铜与浓硝酸反应实验的优点:______________ ;
(4)大烧杯内最终所得气体产物的化学式: ;若要验证此气体产物,最简便的方法:_________________________________________ 。
解析:分析实验现象要从导致产生实验现象的物质开始分析,如从小烧杯发生的反应到产生气体颜色的变化,再到烧杯内液面高度的改变,逐一分析,才能做到全面分析。
答案:(1)Cu+4HNO3 ==Cu(NO3 )2 +2NO↑+2H2O
(2)①铜片表面产生气泡; ②小烧杯中溶液逐渐变成蓝色;③大烧杯中有红棕色气体生成,气体颜色又逐渐褪去;④大烧杯内液面上升,水槽中液面下降。
(3)体系封闭,无氮氧化合物逸出,不污染环境。
(4)NO;轻轻掀起倒扣的大烧杯,放入适量空气,若有红棕色气体生成,最终气体为NO。
[例4] Cu+在酸性溶液中不稳定,可发生自身氧化还原反应生成Cu2+和Cu。现有浓硫酸、浓硝酸、稀硫酸、稀硝酸、FeCl3稀溶液及pH试纸,简述如何用简便的实验方法来检验CuO经氢气还原所得红色产物中是否含有碱性氧化物Cu2O。
解析:由题给信息可知,Cu2O是碱性氧化物,可溶于酸溶液:Cu2O+2H+=2Cu++H2O;而Cu+在酸溶液中不稳定,自身歧化成Cu2+和Cu。2Cu+=Cu2++Cu。题给试剂中,浓硫酸、浓硝酸、稀硝酸、FeCl3稀溶液均显酸性,且都能与Cu反应生成Cu2+,如果选用这些试剂,它们和样品反应后的溶液都呈蓝色(Cu2+),但分不清是与Cu还是与Cu2O反应产生的Cu2+,故无法确证样品中是否含有Cu2O。根据以上分析,选用的试剂必须符合两个条件,一是呈酸性,二是不能与Cu反应。在题给试剂中只有稀硫酸符合。
答案:取少量待检样品放入稀硫酸 ,振荡,若溶液变为蓝色,说明样品中有Cu2O,若溶液不变色,说明产物中无Cu2O。
[例5]孔雀石和石青是自然界存在的两种碳酸盐类铜矿,它们的化学组成可表示为:xCuCO3·yCu(OH)2(x、y为正整数且x≤2,y≤2)
(1)孔雀石和石青分别与过量盐酸反应时,孔雀石消耗的盐酸的物质的量与生成的CO2的物质的量之比为4:1;石青则为3:1,请推算它们的化学组成。
孔雀石__________________________;石青__________________________;
(2)现有孔雀石和石青混合样品,取两份等质量的样品,在一份中加入过量盐酸,生成CO2 3.36 L(标准状况下);加热另一份样品使其完全分解,得到CuO 20 g,试通过计算确定该混合物中孔雀石和石青的物质的量之比 。
解析: (1)设孔雀石的化学式为xCuCO3•yCu(OH)2
则依题意 = = 孔雀石的化学式为 CuCO3•Cu(OH)2
又设石青的化学式为 xCuCO3•yCu(OH)2
则依题意 = = 石青的化学式为 CuCO3•Cu(OH)2
(2)设该样品中孔雀石物质的量分数为x,则石青为 1- x
=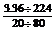 =
=
孔雀石与石青物质的量之比为1:1。
答案:(1)CuCO3•Cu(OH)2;CuCO3•Cu(OH)2 (2) 1:1
1.粗炼
① 火法炼铜(以Cu2S为例) :
② 湿法炼铜
4.铜的配合物
Cu(Ⅱ)一般易形成配位数为4的正方形构型的络离子如[Cu(H2O)4]2+( 色)、 [CuCl4]2-( 色)、[Cu(NH3)4]2+( 色)等
3.硫酸铜
⑴ 无水硫酸铜是 色固体,能溶于水,水溶液呈 色,因此,无水硫酸铜可用于
⑵ 硫酸铜晶体是 色,俗称 、 ,化学式为CuSO4·5H2O,实际为
硫酸铜晶体受热易分解
⑶ CuSO4是制铜盐的重要原料,如波尔多液(原料 、 )
思考:为什么硫酸铜可用于游泳池消毒?
2.铜的氢氧化物
⑴ 氢氧化铜是 色固体,难溶于水,但可溶于氨水
思考:为什么氢氧化铜能溶于氨水?
⑵ 不稳定性(受热易分解)
⑶ 与酸反应(如HNO3、HCl、H2SO4等)
离子方程式
⑷ 弱氧化性(如与葡萄糖反应)
思考:真正与葡萄糖反应的微粒是什么?
1.氧化铜
⑴ 氧化铜是 色粉末状固体(区别于氧化亚铜 色),难溶于水
⑵ 与还原剂(H2 、CO、C)反应
与H2反应
与C 反应
⑶ 与酸反应(如HNO3、HCl、H2SO4等)
离子方程式
2.化学性质
铜是 的金属,通常显+2、+3价
(1)与非金属单质反应
①与O2反应:
②与Cl2反应:
③与S反应:
常温下,铜与在干燥的空气中不发生反应,但潮湿的空气里,表面易形成铜绿。
反应方程式为:
思考:CuCl2无水固体、浓溶液、稀溶液分别呈什么颜色?
写出有关反应式
(2)与酸反应
①一般不与非氧化性酸(如稀硫酸、盐酸)反应产生氢气
②氧化性酸:
(a) 与稀HNO3反应 现象:
反应方程式:
(b) 与浓 HNO3反应 现象:
反应方程式:
(c) 与浓硫酸共热现象:
反应方程式:
(3)与盐溶液反应
①与Hg(NO3) 2反应:
②与FeCl3反应:
1.物理性质:
铜具有 色金属光泽,延展性、导电、导热性较好,且导电性在金属中仅次于 ,其晶体堆积方式属于 ,不能被磁铁吸引。
铜合金种类繁多,主要有青铜(含 )、黄铜(含 )、白铜(含 )。
铜元素位于周期表__周期__族,其电子排布式为 ,原子结构示意图为 :在自然界中主要以 形式存在,如黄铜矿(主要成分为 )、辉铜矿(主要成分为 ),也可以以单质形式存在。
10.饮用水的质量问题是2007年最引人关注的问题之一。大肠菌群是一群以大肠埃希氏菌为主的需氧及兼性厌氧细菌。大肠菌群指数(c。U-index)指1升水中含有的大肠菌群数。大肠菌群指数常用于饮用水、食品、饮料等的卫生检测。检测中规定生活饮用水的水质标准为1升水中大肠菌群不得超过3个,即大肠菌群指数不得大于3。
某人在测定自来水中的大肠杆菌群时,先将5升自来水水样浓缩至5毫升,然后各取浓缩水样1毫升,涂布到4个培养皿中培养,4次培养后计数的菌落数分别是32、38、35、8。请回答下列问题:
(1)根据上述结果计算,被检水样大肠菌群指数为 ,水样 (是、否)达标。
(2)下表是某公司研发的一种测定大肠菌群的配方(g/L)。

从成分看,该培养基的类型是 培养基,可以推测培养基配方中的营养物质应包括碳源、氮源和 。
(3)培养大肠杆菌时,常用的接种方法是平板划线法和稀释平板涂布法,但无论哪种接种方法,其主要目的都是防止杂菌污染,请指出灭菌和消毒这两种方法的差异。
。
[解析]统计菌落数应注意选择菌落数在30-300的平板进行计数,浓缩为1毫升后涂布的4个平板中,有一个的菌落数为8,不能计数,所以被检水样大肠菌群指数为(32+35+38)/3=35(个)。大肠杆菌数超标,为不达标水。培养基中有凝固剂琼脂,可知为固体培养基。培养基的基本营养成分有碳源、氮源、无机盐、水等成分。
[答案](1)35 否
(2)固体(鉴定) 无机盐
(3)消毒是指使用较为温和的物理或化学方法反杀死物体表面或内部一部分对人体有害的微生物(不包括芽孢和孢子)。灭菌则是指使用强烈的理化因素杀死物体内外所有的微生物,包括芽孢和孢子。
3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com