
23.碳酸锂广泛应用于陶瓷和医药等领域。以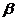 -锂辉石(主要成分为Li2O
-锂辉石(主要成分为Li2O Al2O3
Al2O3 4SiO2)为原材料制备Li2CO3的工艺流程如下:
4SiO2)为原材料制备Li2CO3的工艺流程如下:
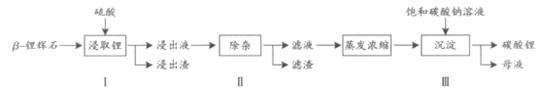
已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的PH分别为3.2、5.2、9.7和12.4;Li2SO4、LiOH和Li2CO3 在303K下的溶解度分别为34.2g、12.7g和1.3g.
在303K下的溶解度分别为34.2g、12.7g和1.3g.
(1)步骤Ⅰ前,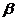 -锂辉石要粉碎成细颗粒的目的是_____________.
-锂辉石要粉碎成细颗粒的目的是_____________.
(2)步骤Ⅰ中,酸浸后得到的酸性溶液中含有Li+、SO42-,另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、Na+等杂质,需在搅拌下加入_____________(填“石灰石”、“氯化钙”或“稀硫酸”)以调节溶 液的PH到6.0~6.5,沉淀部分杂质离子,然后分离得到浸出液。
液的PH到6.0~6.5,沉淀部分杂质离子,然后分离得到浸出液。
(3)步骤Ⅱ中,将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,可除去的杂质金属离子有______________.
(4)步骤Ⅲ中,生成沉淀的离子方程式为________________.
(5)从母液中可回收的主要物质是_____________.
23.某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。

填写下面空白。
(1)图中标号处需加入的相应物质分别是① 、② 、③ 、④ 、⑤ 。
(2)写出①处发生反应的离子方程式 。写出③处发生反应的化学方程式 。
(3)铁红的化学式为 ;分别写出铁红和氧化铜在工业上的一种主要用途:铁红 ;氧化铜 。
22.有A、B、C、D、E和F六瓶无色溶液,他们都是中学化学中常用的无机试剂。纯E为无色油状液体;B、C、D和F是盐溶液,且他们的阴离子均不同。现进行如下实验:
①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;
②将A分别加入其它五中溶液中,只有D、F中有沉淀产生;继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解;
③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出;
④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶。
根据上述实验信息,请回答下列问题:
(1) 能确定溶液是(写出溶液标号与相应溶质的化学式):
(2) 不能确定的溶液,写出其标号、溶质可能的化学式及进一步鉴别的方法:
21.现有A、B、C、D、E、F六种化合物,已知它们的阳离子有K+,Ag+,Ca2+,Ba2+,Fe2+,Al3+,, 阴离子有Cl-,OH-,CH3COO-,NO3-,SO42-,CO32-,,现将它们分别配成0.1mol·L-1的溶液,进行如下实验:
阴离子有Cl-,OH-,CH3COO-,NO3-,SO42-,CO32-,,现将它们分别配成0.1mol·L-1的溶液,进行如下实验:

 ①测得溶液A、C、E呈碱性,且碱性为A>E>C;
①测得溶液A、C、E呈碱性,且碱性为A>E>C;

 ②向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
②向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;

 ③向D溶液中滴加Ba(NO3)2溶液,无明显现象;
③向D溶液中滴加Ba(NO3)2溶液,无明显现象;

 ④向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
④向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。

 根据上述实验现象,回答下列问题:
根据上述实验现象,回答下列问题:
(1) 
 实验②中反应的化学方程式是
实验②中反应的化学方程式是

 (2)E溶液是 ,判断依据是
(2)E溶液是 ,判断依据是

 ;
;

 (3)写出下列四种化合物的化学式:A
、C
、
(3)写出下列四种化合物的化学式:A
、C
、
 D 、F
.
D 、F
.
20.
 能正确表示下列反应的离子方程式是 ( )
能正确表示下列反应的离子方程式是 ( )
A.甲酸钠溶液和盐酸反应:HCOO-+H+ HCOOH
B.硫化钠的第一步水解:S2-+2H2O H2S+2OH-
C.醋酸钡溶液和硫酸反应:Ba2++SO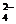
BaSO4↓
D.氢氧化钙溶液和碳酸氢镁反应:Ca2++OH-+HCO3-
CaCO3↓+H2O
19.下列离方程式书写正确的是
A、石灰乳与Na2CO3溶液混合:Ca2++CO32-=CaCO3
B、NH4HSO3溶液与足量的NaOH溶液混合加热:NH4++HSO3-+2OH- NH3Ÿ+SO32-+2H2O
NH3Ÿ+SO32-+2H2O
C、酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+3H2O=3I2+6OH-
D、AgNO3溶液中加入过量的氨水:Ag++NH3·H2O=AgOH +NH4+
18.能正确表示下列反应的离子方程式是
A.醋酸钠的水解反应 CH3COO-+H3O+=CH3COOH+ H2O
B.碳酸氢钙与过量的NaOH溶液反应 Ca2++2HCO3-+2OH-=CaCO3↓+ 2H2O+ CO32-
C.苯酚钠溶液与二氧化碳反应 C6H5O-+ CO2+ H2O=C6H5OH+CO32-
D.稀硝酸与过量的铁屑反应 3Fe+8H++2NO3-=3Fe3++2NO↑+4 H2O
17.下列反应的离子方程式正确的是
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2OFe(OH)3↓+3H+
B.用小苏打治疗胃酸过多:HCO3-+H+===CO2↑+H2O
C.实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-Cl2↑+Mn2++H2O
D.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu===Fe2++Cu2+
16.下列反应的离子方程式书写正确的是
A 氯化铝溶液中加入过量氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
B 澄清石灰水与少量苏打溶液混合:Ca2++OH-+HCO3-=CaCO3↓+H2O
C 碳酸钙溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O
D 氯化亚铁溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl-
15.下列离子方程式正确的是
A.碳酸氢钠溶液与少量石灰水反应 HCO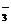 + Ca2+ + OH- = CaCO3↓ + H2O
+ Ca2+ + OH- = CaCO3↓ + H2O
B.氯化铵与氢氧化钠两种浓溶液混合加热OH- + NH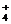 △
H2O
+ NH3↑
△
H2O
+ NH3↑
C.氢氧化镁与稀硫酸反应 H+ + OH- = H2O
D.单质铜与稀硝酸反应 Cu + 2 H++ 2NO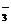 = Cu2+ + 2NO↑+H2O
= Cu2+ + 2NO↑+H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com