
5.下列关于砷(As)元素的叙述中,正确的是( )。
(A)在AsCl3分子中,砷原子最外层电子数为8
(B)砷的相对原子质量为74.92,由此可知砷原子核内有42个中子
(C)砷的氢化物的化学式为AsH3,它是一种强氧化剂
(D)砷酸(H3AsO4)是强酸,其酸性与硫酸相似
答案:A。
4.在一定温度和压强下,将装有N2和NO2混合气体的试管倒立于水槽中,最后试管内气体的体积缩小为原体积的 ,则混合气体中N2与NO2的体积比是( )。
,则混合气体中N2与NO2的体积比是( )。
(A)2:3 (B)3:2 (C)3:5 (D)5:3
答案:A。
3.在城市空气中含有浓度较大的一氧化碳、氮的氧化物等大气污染物,这些污染物的主要来源是( )。
(A)硫酸工业排放的废气 (B)氨氧化法制硝酸中吸收塔排放的废气
(C)汽车尾气 (D)煤炭不完全燃烧产生的废气
答案:C。
2.关于磷的下列叙述中,正确的是( )
(A)红磷没有毒性而白磷有剧毒 (B)白磷在空气中加热到260℃可转变为红磷
(C)白磷可用于制造安全火柴 (D)少量白磷应保存在水中
答案:AD。
3.一氧化氮、氧气同时跟水反应:4NO+3O2+H2O = 4HNO3
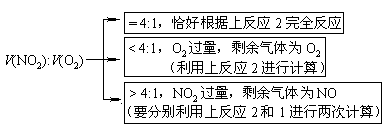
遇到这类计算题时,首先要弄清所涉及的反应原理是哪种情况,再进行计算。如,二氧化氮跟氧气的混合气体溶于水时,可能有以下向种情况:
[例题讲解]
[例1]将盛有氮气和二氧化氮混合气体的试管倒立于水中,经过足够时间后,试管内气体体积缩小为原体积的一半,则原混合气体中氮气和二氧化氮的体积比是 。
[分析]氮气跟水不反应,所以可根据“3NO2+H2O=2HNO3+NO”用体积差法进行计算。
答案为:1:3。
[例2]
将容积为50mL的量筒内充满NO2和O2的混合气体,倒置量筒在盛满水的水槽里,足够时间后,量筒里剩余气体体积为5mL。则混合气体中NO2和O2体积比可能是 。
[分析]二氧化氮、氧气混合气体例置于水中,最后残留气体可能有二种情况,一是氧气,二是一氧化氮。所以应先假设,再立式计算。
[解答](1)若剩余的5mL气体是O2,则共有45mLNO2、O2混合气体跟水反应,根据4NO2+O2+H2O = 4HNO3可得出:
V(NO2)= ×45mL=36mL
×45mL=36mL
V(O2)= ×45mL+5mL=14mL
×45mL+5mL=14mL
所以,原混合气体中NO2和O2体积比为18:7。
(2)若剩余的5mL气体是NO,则NO2、O2混合气体跟水反应时是NO2过量,过量的NO2再跟水反应。根据反应“3NO2+H2O=2HNO3+NO”可得出,共有15mLNO2过量。
即,在NO2、O2混合气体跟水反应的过程中共消耗气体35mL。根据4NO2+O2+H2O = 4HNO3可得出:
V(O2)= ×35mL=7mL
×35mL=7mL
V(NO2)= ×35mL+15mL= 43mL
×35mL+15mL= 43mL
所以,原混合气体中NO2和O2体积比为43:7。
2.二氧化氮、氧气同时跟水反应:4NO2+O2+H2O = 4HNO3
分析反应原理:
1.二氧化氮跟水反应:3NO2+H2O=2HNO3+NO
[演示实验]二氧化氮跟水反应。装置如下图所示(一支10mL量筒)。
(1)轻轻摇动量筒,观察现象(水位逐渐上升,红棕色逐渐变浅)。
(2)用大拇指按住量筒口,取出量筒倒转振荡,再插入水中,观察现象。(水位迅速上升至量筒容积约 ,剩余
,剩余 体积的无色气体)。
体积的无色气体)。
(3)将量筒口用橡胶塞塞住,从水中取出量筒,往量筒中滴入紫色石蕊试液,观察现象(溶液变红)。
通过以上实验的分析引出下列问题。
6.(2007宁波)面积为l个平方单位的正三角形,称为单位正三角形.下面图中的每一个小三角形都是单位正三角形,三角形的顶点称为格点.在图1、2、3中分别画出一个平行四边形、梯形和对边都不平行的凸四边形,要求这三个图形的顶点在格点、面积都为l2个平方单位.

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com