
5、27.8g;①②④③⑤;偏低;重新配制。
4、(1)10.0g
(2)高于;将左边的平衡螺母左旋移动或将右边的平衡螺母左旋,直至天平平衡;32.6g ↓↑;↓;↓↑;↓;↓↑;
(3)①③④②⑤ (4)ACD
1、B 2、B 3、C
例1、A:② ③ ⑥; ① ③; ④ ⑤; ② ③
B:①用标准盐酸润洗滴定管2-3次 ②a(V2-V1)/V mol / L ;
C: C; D: ①
例2、② ⑤ ⑦ ⑧
例3、①溶解过滤 ② 使铁离子全部转化而铜离子没有沉淀 ③ 蒸发浓缩、冷却结晶
受热均匀且温度不超100℃
9、下图为中学常用定量仪器的部分结构(有的仪器被放大),回答下列问题:
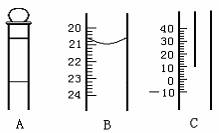
⑴ 中和热测定实验中应用到上述仪器中的 (填序号),该仪器在中和热测定实验中放置的位置是 ;
⑵ 配制一定物质的量浓度溶液的实验中应用到上述仪器中的 (填序号),如果读数时视线偏高,则所得溶液的物质的量浓度将 (填“偏大”“偏小”或“不变”);
⑶ 若B仪器漏水,则应采取的措施是 。
第1讲:常用仪器及基本操作
8、海水的综合利用可以制备金属镁,其流程如下图所示:
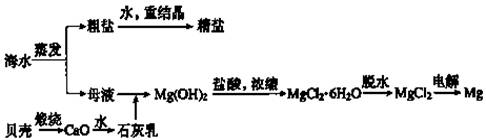
(1)若在空气中加热MgCl2·6H2O生成的是Mg(OH)Cl或MgO,写出相应反应的化学方程式______________________________________________________;
Mg(OH)2沉淀中混有Ca(OH)2应怎样除去?写出实验步骤。
_______________________________________________________________________
(2)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发步骤的操作中都要用到玻璃棒,这三个步骤中玻璃棒的作用依次是
、 、 。
(3)下列有关实验过程中,肯定不需要使用玻璃棒进行操作的是(填字母代号)_______ 。
A.一定溶质质量分数溶液的配制
B.用适量的蔗糖、浓硫酸和水在小烧怀中进行浓硫酸的脱水性实验
C.用普通漏斗组成的过滤装置进行过滤实验
D.用浓氨水和浓盐酸进行氨和氯化氢反应的实验
E.用已知浓度的盐酸和未知浓度的氢氧化钠溶液进行中和滴定实验
F.硫酸铜晶体里结晶水含量测定的实验
G.将适量氯化铁饱和溶液滴入沸水中制氢氧化铁胶体
7、某化学兴趣小组按照下列方案进行“由含铁废铝制备硫酸铝晶体”的实验:
步骤1:取一定量含铁废铝,加足量的NaOH溶液,反应完全后过滤。
步骤2:边搅拌边向滤液中滴加稀硫酸至溶液的pH=8-9,静置、过滤、洗涤。
步骤3:将步骤2中得到的固体溶于足量的稀硫酸。
步骤4:将得到的溶液蒸发浓缩、冷却、结晶、过滤、干燥。
请回答以下问题:
⑴上述实验中的过滤操作需要玻璃棒、______________、______________等玻璃仪器。
⑵步骤1过滤的目的是__________________________________________。
⑶当步骤2中的溶液pH=8-9时,检验沉淀是否完全的方法是______________。
⑷步骤2中溶液的pH控制较难操作,可改用____________________。
6、某学生课题研究小组为了从海带中检验出碘并测定其含量,进行了以下“过程I”至“过程V”的实验操作和资料查阅。
过程I:将海带转化为海带灰的提取液。

过程II:在试管里取1mL提取液,滴入新制氯水,再加入两滴淀粉溶液,观察到溶液不呈蓝色。得出提取液中不含I-的错误结论。
过程II:查阅有关资料。发现:碘单质与氯水反应会生成+5价碘。
过程IV:在试管里取1mL提取液,加入2滴淀粉溶液,再逐滴加入氯水,观察到溶液呈蓝色,继续滴加氯水,溶液呈无色,从而证明了海带中含碘元素。
过程V:取20mL海带灰提取液于锥形瓶中,加入淀粉溶液作指示剂,用a mol·L-1的氯水进行滴定,达滴定终点测得用去氯水V mL.
(1)过程I的实验操作③的名称是_______。为完成过程I,除了铁架台(附铁圈)、三脚架、泥三角、酒精灯、滤纸、玻璃棒、烧杯和剪刀外,还必需的仪器有_______、_____ _、 。步骤③的实验操作名称是 ;
(2)过程II的实验导致错误结论的原因可能(用有关化学方程式填写)
________________ 。
(3)过程V的实验中,滴定终点时溶液颜色变化_______ _;
按实验结果计算,海带灰提取液中I-的浓度为______ _mol·L-1.
5、要配制500mL0.2mol/L的FeSO4溶液,实验步骤有:①在天平上称取ag绿矾(FeSO4·7H2O)将它放在烧杯中,用适量蒸馏水使其完全溶解;②将所得溶液沿玻璃棒注入500mL容量瓶中;③继续向容量瓶中加水至液面距刻度线1-2cm处,改用胶头滴管加蒸馏水至液面凹面最低处与刻度线相平;④用少量水洗涤烧杯和玻璃棒2-3次,每次洗液都转入容量瓶;⑤将容量瓶塞紧,充分摇匀。填写下列空白:
(1)ag绿矾的实际质量是__________ _;
(2)上述操作步骤的正确顺序为____________________ _;
(3)若配制时遗漏步骤④,会使所配溶液的浓度_________(填“偏高”、“偏低”、“无影响”);
(4)若定容时加蒸馏水不慎超过刻度线,处理方法是_____________________。
4、配制500mL0.50mol/L的NaOH溶液,试回答下列问题。
(1)计算:需要NaOH固体的质量为
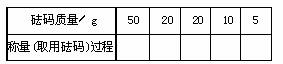
(2)某学生用托盘天平称量一个小烧杯的质量,称量前把游码放在标尺的零刻度处,天平静止时发现指针在分度盘的偏右位置,此时左边的托盘将 (填“高于”或“低于”)右边的托盘。欲使天平平衡,所进行的操作应
为 。
假定最终称得的小烧杯的质量为 (填32.6或32.61)请用“↓”表示在托盘上放上砝码,“↑”表示从托盘上取下砝码的过程,并在标尺上画出游码位置(画“△”表示)

(3)配制方法:设计五个操作步骤:
①向盛有NaOH的烧杯中加入200 mL蒸馏水使其溶解,并冷却至室温。
②继续往容量瓶中加蒸馏水至液面接近刻度线2cm-3cm。
③将NaOH溶液沿玻璃棒注入500 mL容量瓶中。
④在烧杯中加入少量的蒸馏水,小心洗涤2-3次后移入容量瓶。
⑤改用胶头滴管加蒸馏水至刻度线,加盖摇匀。
试按操作步骤重新排序 。
(4)某学生实际配制NaOH溶液的浓度为0.48mol/L,原因可能是 。
A.使用滤纸称量氢氧化钠固体 B.容量瓶中原来存有少量蒸馏水
C.溶解后的烧杯未经多次洗涤 D.胶头滴管加水后定容时仰视刻度
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com