
3.实验设计方案的评价:
①科学性(即实验原理、操作程序和方法必须正确);
②安全性(即用药及操作要注意安全,注意环境保护等问题);
③可行性(要满足中学现有的实验条件);
④简约性(装置简单、步骤少、药品用量少、时间短)。
2. 实验设计方案的思路
(1)制备实验方案的设计思路
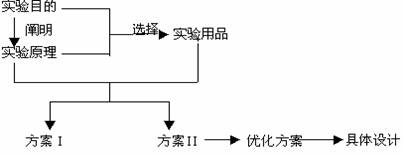
(2)性质实验方案的设计思路
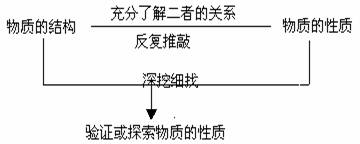
(3)物质检验实验方案的设计思路
①对试样进行外观观察,确定其颜色、气味、状态等。
②准备试样进行检验,当试样是固体时应先取少量配成溶液,同时观察试样是否溶解,在溶解时有无气体产生等,以初步判断试样可能含有哪类物质。
③ 根据实验现象得出结论。
1.化学实验方案设计的内容
一个相对完整的化学实验方案设计包括下述内容:
(1)实验 (2)实验 ;(3)实验 ;(4)实验 (仪器、药品及规格);(5)实验 (包括实验仪器装配和操作);(6)实验 ;(7)问题讨论
掌握化学实验的 记录方法和运用化学知识设计一些基本实验。具体为:
(1)根据实验现象,观察、记录、分析或处理数据,得出正确结论。
(2)根据实验试题要求,设计或评价实验方案。
(3)能绘制和识别典型的实验仪器装置图。
10、(1)D (2)折除B、C装置,在空气中冷却
(3)连续两次称量质量相差小于0.1g
(4) 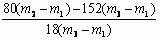
(5) 可能是SO3,将其溶于水后,用BaCl2,HCl溶液检验
 (6) 2FeSO4·nH2O Fe2O3
+ SO3↑+ SO2↑+ 2nH2O
(6) 2FeSO4·nH2O Fe2O3
+ SO3↑+ SO2↑+ 2nH2O
9、⑴ 稀盐酸 KSCN溶液 2Fe2++Cl2=2Fe3++2Cl-
Fe3++SCN-=[Fe(SCN)]2+ 加入KSCN后显红色
4Fe2++4H++O2=4Fe3++2H2O
⑶ 不合理 我的猜想是SCN-被过量的氯水氧化。设计的实验为在褪色后溶液加入FeCl3溶液,仍不变红色(或在褪色后溶液加入KSCN溶液,变红色)
8、(1)取两支试管分别装未知液,向其中加入BaCl2溶液。
(2)待沉淀下沉后,取上层清液,加入另一试管中,若沉淀溶解,则原未知液为Na2SO3,若沉淀不溶解原未知液为H2SO4。
7、各取三种未知液少许,分别滴入2滴酚酞试液,溶液显红色的原溶液为NaOH溶液,另取余下的两种未知液,分别向其中加入含有酚酞试液的NaOH溶液,可使溶液褪色的原溶液是盐酸,余下的原溶液为食盐溶液。
1.C 2.C 3.D 4.D 5.C 6.B
10.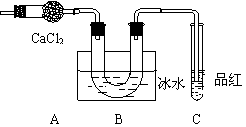 某学生设计如下实验,用于检验硫酸亚铁晶体(FeSO4·nH2O)分解产物并测定其结晶水的n值,步骤如下:
某学生设计如下实验,用于检验硫酸亚铁晶体(FeSO4·nH2O)分解产物并测定其结晶水的n值,步骤如下:
① 在质量为m1g的某容器中放入适量的
已研碎的硫酸亚铁晶体,再称量为m2g;
① 在隔绝空气的条件下,将晶体强热,
并将气态产物通过如下装置(设每步吸收均
是完全的),直至晶体全部变为红棕色粉末
为止,发现U形管底部有无色晶体析出,
品红溶液褪色。
③ 将红色粉末冷却至温室,称量(连容器)为m3g
④ 重复加热、冷却、称量、直至合格为止
回答下列问题:
(1) 第①步实验中盛放晶体的容器是(从下列选出)
A.坩埚 B. 蒸发皿 C. 烧瓶 D. 石英试管
(2) 第③步实验应如何冷却? ;
(3) 第④步实验称量合格的标准是 ;
(4) 求n值的计算式是 ;
(5) U形管中的晶体可能是什么物质?如何检验? ;
(6) 根据实验结果,写出FeSO4·nH2O分解化学方程式(化学计量数可用n表示)
第4讲 物质的检验、分离和提纯
例1、(1)pH试纸 (2)NaOH (3)HCl (4)蒸馏水
例2、D
例3从浓硫酸中取出铜片,用水洗干净后,放入稀硫酸中,如溶液呈蓝色,说明铜发生了钝化,否则没有钝化
例4(1)合理
(2)用磁铁吸引,若能吸附,说明有铁生成
(3)NaOH溶液 取少量样品放入试管,加入NaOH溶液, 有气泡产生,说明该熔融物中有铝。
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
例5(1)Br2;Fe3+
(2)乙
|
实验方案 |
选用试剂(填代号) |
实验现象 |
|
方案一 |
C |
有机层无色 |
|
方案二 |
D |
溶液变红 |
(3)Fe2+;不可以,因为Br2和Fe3+都能把I-氧化成I2
课堂练习
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com