
①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,有少量气泡产生,溶液浅黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
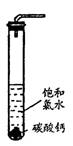 ③为了确定反应产物,将滤液分为三份,分别进行以下实验:
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生。
经检测,上述实验中产生的无色气体均为CO2。请回答:
(1) 试解释可以在饱和氯水中加入石灰石制备HClO的原因
(2)写出步骤③中第一份及第二份滤液发生反应的离子方程式:
第一份: 。
第二份: 。
(3)试根据所学知识推测,在②的滤液中含 有的溶质,除了溶解的极少量氯气外,还含有的其它溶质为(写化学式) 。
4.饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一。2005年的《化学教育》报道了如下实验研究:
6.85gPbxOy粉末,(装置气密性良好)。
⑵打开活塞K,通入H2,排尽装置内的空气后,点燃A处酒精灯,
进行反应。C装置的作用是: 。
⑶待A中反应完全后,停止加热,仍要继续通入H2一段时间,
其目的是:
⑷卸下装置B,称量,发现增重0.72g,则该铅的氧化物化学式为:
。
3.某兴趣小组为了验证某种铅的氧化物(PbxOy)中含有氧元素并测定其化学式,设计了如下两套实验方案:[已 知:Pb4+比Pb2+氧化性更强]
按实验方案,填写下列空白:
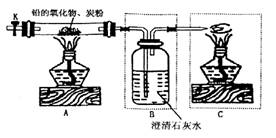
方案一:
⑴按上图连接好装置(B中已盛有适量水),检查装置的气密性。简述检查A装置气密性的方法
⑵在A中硬质玻璃管内装入该铅的氧化物和炭粉混合 物,B中洗气瓶内装入足量澄清石灰水。依次点燃A、C两处酒精灯。
若PbxOy中含有氧元素,则加热一段时间后,B中可能观察到的实验现象是:
写出A中铅的氧化物和炭粉发生反应的化学方程式(只要求写一个)
。
⑶实验结束时,先熄灭C处酒精灯,再取出B中导管,最后熄灭A处酒精灯。如果操作顺序相反,可能会出现什么现象?
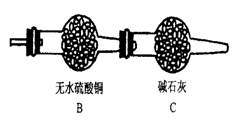 方案二:
方案二:
⑴将B、C改为如下图所示的装置,在A中硬质玻璃管内放入
2.某校开展从废旧干电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质课外研究性学习活动,整个过程如下:
⑴干电池工作时正极上的反应是NH4++e-=NH3+ H2,该电极反应属于
H2,该电极反应属于
反应(选填“氧化”或“还原”),MnO2的作用是除去正极上的产物,本身生成Mn2O3,该反应的化学方程式是
。
⑵锌皮和碳棒的回收:用钳子和剪子剪开回收的干电池的锌筒,将锌皮和碳棒取出,刷洗干净,将电池内的黑色粉末移入小烧杯中。
⑶氯化铵、氯化锌的提取、检验
①向小烧杯中加入一定量的热蒸馏水,充分搅拌, ,所得晶体即为ZnCl2、NH4Cl。
②设计简单的实验证明所得晶体中含有NH4+和Zn2+,并填写下列实验报告。
|
实验步骤 |
实验现象 |
实验结论 |
有关离子方程式 |
|
第一步:取少量晶体溶于蒸馏水配成溶液 |
  |
|
 |
|
第二步: |
|
说明有NH4+ |
|
|
第三步:取少许溶液,加适量氨水,将悬浊液分成两份,一份加稀HCl,一份加足量NaOH溶液。 |
先生成白色沉淀,后沉淀都溶解 |
说明有Zn2+ |
 |
有同学提出第三步Zn2+的检验所得结论不可靠,其原因是
1.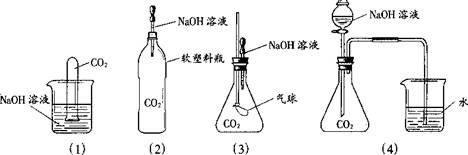 为探究CO2和NaOH确实发生了化学反应,某实验小组的同学设计了下列4种实验装置,请回答下列问题:
为探究CO2和NaOH确实发生了化学反应,某实验小组的同学设计了下列4种实验装置,请回答下列问题:
(1)选择实验装置(3),简述出现的实验现象以及产生该实验现象的原因:_______________________________ 。
⑵某同学质疑上述所有实验设计,该同学质疑的依据是______________________________ _
⑶在原实验的基础(4)上,请你设计实验证明CO2和NaOH肯定发生了化学反应。____________________________________________________________________________ 。
|
|
例1已知Cu2S、CuS粉末的颜色和CuO粉末相似,且都不溶于水。在空气中煅烧Cu2S和CuS都转化为SO2和CuO。试根据上述性质,设计一个鉴别Cu2S、CuS和CuO三种黑色粉末的简单的实验方案。
例2学习了元素周期律后,同学们对第四周期过渡元素氧化物产生了浓厚的兴趣。是否只有二氧化锰能催化氯酸钾受热分解?氧化铁、氧化铜、氧化铬等对氯酸钾的受热分解有没有催化作用?对此他们进行了实验探究。请你根据要求完成下列部分实验报告。
I 课题名称:_________________________________________________
II实验仪器及试剂:
实验仪器:带铁夹的铁架台、带橡皮塞的导管、量气装置、过滤装置、电子天平、药匙、________、________、________等。
实验试剂:二氧化锰、氧化铁、氧化铜、氧化铬和氯酸钾
III 实验步骤:略
IV 实验数据:
|
实验 编号 |
KClO3(g) |
氧化物 |
产生气体(mL) |
耗时(s) |
||
|
化学式 |
质量(g) |
回收 |
(已折算到标况) |
|||
|
1 |
0.60 |
- |
- |
- |
10 |
480 |
|
2 |
0.60 |
MnO2 |
0.20 |
90% |
67.2 |
36.5 |
|
3 |
0.60 |
CuO |
0.20 |
90% |
67.2 |
79.5 |
|
4 |
0.60 |
Fe2O3 |
0.20 |
90% |
67.2 |
34.7 |
|
5 |
0.60 |
Cr2O3 |
0.20 |
异常 |
67.2 |
188.3 |
V 实验讨论:
(1) 在氧化物的回收过程中,要进行过滤操作,所用的玻璃仪器是玻璃棒、
_________ 、_______ _
(2)实验编号3的实验中KClO3的分解率为_________%(保留一位小数)
(3) 在用Cr2O3 做研究实验时,发现有刺激性气味的气体产生,同时绿色的混合物变成了橘黄色。该刺激性气体是________(填分子式),可用______________试纸检验。上述异常现象产生的原因是___________________________________。
VI 实验结论:______________________________________________________
例3某研究性学习小组为探究铜、锌与浓盐酸反应,设计实验探究方案如下:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com