
5.防导管堵塞。
①制气装置若发生导管堵塞,将导致装置内压强增大,液体喷出。因此,制氧气和乙炔时,发生装置的导管口附近要塞一团疏松的棉花,以防导管被固体或浆状物堵塞。(你还见过哪些分堵塞的装置?)
4.防液体倒吸。
①氯化氢和氨气等易溶性气体溶于水要连接防倒吸的装置;
②加热氯酸钾制氧气等实验并用排水法收集后,停止加热前应先将导气管从水中取出;
③实验室制乙酸乙酯,因装置内气压不稳定,也要防倒吸。
3.防液体飞溅。
①浓硫酸与水、浓硝酸、乙醇等混合时,应将浓硫酸小心沿容器壁慢慢加入另一液体中,边加边振荡。而不能将液体注入浓硫酸中,更不要将浓硫酸与碳酸钠溶液混合;
②加热沸点较低的液体混合物时,要加细瓷片以防暴沸;加热试管中的液体,管口不能对人;
③蒸发溶液要用玻璃棒搅拌。
2.防仪器炸裂。
①给烧瓶、烧杯等加热时要垫石棉网;在试管中加热固体时(如制氧气、制氨气、制甲烷、氢气还原氧化铜等),管口要略向下倾斜;
②在集气瓶中点燃金属时,瓶中要加少量水或铺一层细沙;
③玻璃仪器加热前外壁要干燥,在加热过程中不能逐及焰芯;
④热仪器不能立即用水刷洗。
化学实验安全须做到以下“十防”:
1.防爆炸。
①可燃性气体(如H2、CO、CH4、C2H4、C2H2等)在空气中达到爆炸极限点燃时都会发生爆炸,因此点燃这些气体前均须检验纯度,进行这些气体实验时应保持实验室空气流通;
②H2还原CuO,CO还原Fe2O3等实验,在加热之前应先通气,将实验装置内的空气排出后再加热,防止与装置内空气混合受热发生爆炸。
③活泼金属与水或酸反应要注意用量不能过大;
④银氨溶液应现配现用,并且配制时氨水不能过量。
了解实验室一般事故的预防和处理方法。
4、(1)在饱和氯水中存在如下平衡:Cl2+H2O  HClO +HCl,加入过量的CaCO3与溶液中的HCl发生反应,使盐酸的浓度减小,平衡向正反应方向移动,最终生成HClO
HClO +HCl,加入过量的CaCO3与溶液中的HCl发生反应,使盐酸的浓度减小,平衡向正反应方向移动,最终生成HClO
(2)

(3)HClO、Ca(HCO3)2、CaCl2
(4)在导管末端再连接长导管 , 使导管的出口接近量筒底部
(5) 碳酸钙与氯水反应生成的 Ca(HC03)2 再受热时 , 除生成 CO2 外 , 还生成了 CaC03
(6)从圆底烧瓶蒸出的水蒸气在广口瓶中冷凝、聚集
3、方案一:
⑴关闭活塞K,用手捂住A中硬质玻璃管,B中长导管管口有气泡冒出;移开双手后,B中长导管内有一段高出液面的水柱,一段时间不下降,说明气密性良好。(其它方法只要合理可行,也给分)
⑵有气泡产生,石灰水变浑浊(或有气泡产生,石灰水可能变浑浊,也可能不变浑浊)
PbxOy+xC xPb+YCO或PbxOy+yC
xPb+YCO或PbxOy+yC 2xPb+yCO2
2xPb+yCO2
⑶B中液体倒吸进入A中
方案二:
⑵防止空气中的H2O进入B装置
⑶将A中H2O蒸气全部赶入B中
⑷Pb3O4
2、(1)还原 2MnO2+H2===Mn2O3+H2O
(3)①趁热过滤,将滤液冷却(再过滤)
②第二步:取少许溶液,加NaOH加热,在试管口附近放湿润红色石蕊试纸 试纸变蓝 NH4++OH- NH3↑+H2O
NH3↑+H2O
Al(OH)3也具有两性,无法判断原溶液中是Zn2+还是Al3+
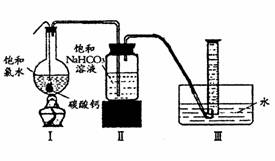 在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙和150mL饱和氯水,按如图所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加。
在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙和150mL饱和氯水,按如图所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加。
请回答:
(4)为减少用装置Ⅲ收集气体过程中CO2因溶解而造成的损失,且水槽中仍然为水,请你对装置Ⅲ进行改进,最简单的方法是
(5)用改进后的装置进行上述实验,测得塑料网内的碳酸钙质量减少Ag,总共收集到标准状况下的CO2气体BL,发现 明显小于
明显小于 。若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是
。若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是
____________
(6)实验后发现,装置Ⅱ中的液体增多了,其原因是________________
________________ 。
第5讲 化学实验方案设计与评价
例1取等质量的三种样品,分别在空气中灼烧。
灼烧后质量不变且无现象的是CuO;质量不变但有刺激性气味气体产生的是Cu2S;质量减轻且有刺激性气味气体产生的是CuS。
例2探究氧化铁、氧化铜、氧化铬对氯酸钾受热分解反应的催化作用,或二氧化锰、氧化铁、氧化铜、氧化铬催化能力的比较。
大试管、酒精灯、计时器(或秒表);(1)普通漏斗;烧杯 (2)40.8 (3)Cl2;湿润的碘化钾淀粉试纸;KClO3与Cr2O3 发生了氧化还原反应
氧化铁、氧化铜、二氧化锰等都可作为KClO3受热分解的催化剂或氧化铁的催化能力和二氧化锰的催化能力较好。
例3(1)铜、锌及浓盐酸一起组成了原电池,加快了反应速率
(2)①没有道理,因为氢气本身难溶于水
②
|
将铜片加入稀硫酸中,并微热 |
若无气体放出,则不含锌等活泼金属杂质;若有气体则有锌等杂质 |
(3)
|
戊 |
预计验证方法 |
预测的现象与结论 |
|
白色沉淀是氯化亚铜 |
白色沉淀加入稀盐酸中,通入氧气 |
溶液变蓝色,说明是一价铜 |
|
向氯化亚铜悬浊液中加入氯化钾浓溶液 |
若白色沉淀消失且得无色溶液,则原白色沉淀为氯化亚铜,否则不是。 |
(4)2Cu + 8HCl = 2H3[CuCl4] + H2↑(或:2Cu +4HCl = 2H[CuCl2] +H2↑;
2Cu +6HCl=2H2[CuCl3] +H2↑);
[CuCl4]3-(aq) 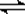 CuCl(s)
+ 3Cl-(aq)
CuCl(s)
+ 3Cl-(aq)
或: [CuCl2]-(aq) 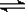 CuCl(s)
+ Cl-(aq);
CuCl(s)
+ Cl-(aq);
[CuCl3]3-(aq) 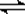 CuCl(s)
+ 2Cl-(aq)]
CuCl(s)
+ 2Cl-(aq)]
(5)用变量控制法探讨铜与盐酸发生反应生成氢气和白色沉淀,盐酸的适宜浓度(其它合理答案均给分)
例4[实验设计]
方法一:B;Fe+H2SO4=FeSO4+H2↑、FeSO4+2NaOH=Fe(OH)2↓+Na2SO4、
H2SO4+2NaOH=Na2SO4+2H2O 中和反应方程式不写不扣分
方法二:⑦、⑨或⑦、⑧、②。
[探究思考]
(1)由于Fe(OH)2部分被氧化,混入少量的Fe(OH)3。
|
(2)打开,发生,Fe(OH)2·nH2O= Fe(OH)2+ nH2O。
(3)向Fe2+和Fe3+的混合液中加入NaOH溶液后,观察生成的沉淀的颜色是否为灰绿色(或者可以将Fe(OH)3和Fe(OH)2混合后观察其颜色。)(合理答案均给分)
课堂练习
1、(1)气球变大;CO2与NaOH反应,使试管内压强减小.
(2)上述四种装置只能说明CO2减少(也可能是CO2溶解于水所致),并不能说明CO2一定和NaOH反应.
(3)取上述实验后的液体,滴加CaCl2溶液,若出现白色沉淀,说明原实验中生成了CO32-,即CO2和NaOH混合后产生的新物质,发生了化学反应.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com