
6.答案:C
解析:此题主要考查元素周期表中,同周期同主族元素性质的一些递变规律,在同周期中零族元素的原子半径最大,而在同主族中,半径越大,越难得电子。单原子离子的化合价和它的族序数不一定相等,如ⅣA铅形成的Pb2+。
5.答案:C
解析:ⅦA族元素易得一个电子形成-1价阴离子且最外层达稳定结构,氢元素如果能形成-1价阴离子,且最外层达稳定结构,即可说明可以放在ⅦA族。在NaH中,H为-1价阴离子。
4.答案:A
解析:此题考查了原子结构、元素在周期表中的位置与物质性质的关系。最高价含氧酸的相对分子质量为98的酸常见有两种:硫酸和磷酸。且磷元素的氢化物的分子式不是H2X,而是PH3,故X应为磷。
3.答案:B
解析:分析此题时首先要明确两元素不可能在同一周期,如在同一周期则是一种元素。即只能是一种元素在第一周期,另一元素在第二周期。所以两元素最外层电子数之比为1∶2。第一周期的元素的最外层电子数是1或2,则另一元素的最外层电子数为2或4。
2.答案:A
解析:由题意可知X为H、Li、Na三种元素中的一种,Y为P,Z为O,则P在含氧酸及其盐中可呈+3、+5两种价态,A中Y为+6价,故A不可能。
1.答案:A
解析:金属元素也能形成含氧酸及其含氧酸盐,如高锰酸钾;氧、氟两非金属元素不能形成含氧酸。许多含氧酸如碳酸、磷酸不具有强氧化性,故B、C、D均不正确。
30.(1995年上海,30)今有A、B、C、D四种短周期元素,它们的核电荷数依次增大,A与 C、B与D分别是同族元素,B、D两元素的质子数之和是A、C两元素质子数之和的两倍,这四种元素中有一种元素的单质能溶解于CS2溶剂中,则四种元素是:A___________、B 、C 、D 。
●答案解析
29.(1999年上海,26)设想你去某外星球做了一次科学考察,采集了该星球上十种元素单质的样品,为了确定这些元素的相对位置以便系统地进行研究,你设计了一些实验并得到下列结果:
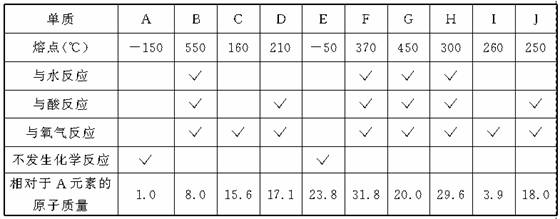
按照元素性质的周期递变规律,试确定以上十种元素的相对位置,并填入下表:
28.(2000年上海,25)不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如图所示。
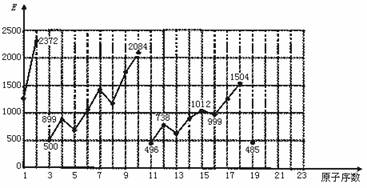
试根据元素在周期表中的位置,分析图中曲线的变化特点,并回答下列问题。
(1)同主族内不同元素的E值变化的特点是:______________________________。各主族中E值的这种变化特点体现了元素性质的___________ 变化规律。
(2)同周期内,随原子序数增大,E值增大。但个别元素的E值出现反常现象。试预测下列关系式中正确的是___________ (填写编号,多选倒扣)
①E(砷)>E(硒) ②E(砷)<E(硒)
③E(溴)>E(硒) ④E(溴)<E(硒)
(3)估计1 mol气态Ca原子失去最外层一个电子所需能量E值的范围:
___________ <E<___________
(4)10号元素E值较大的原因是__________________________________________。
27.(2000年春,32)第Ⅳ主族元素R,在它的化合物R(OH)n中,其质量分数为0.778,在它的另一种化合物R(OH)m中,其质量分数为0.636。
(1)试求n和m的值:n=_____________,m=_____________。
(2)试求R的相对原子质量a=_____________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com