
|
化学式 |
FeO |
Fe2O3 |
Fe3O4 |
|
颜色、状态 |
|
|
|
|
溶解性 |
|
|
|
|
铁的化合价 |
|
|
|
|
稳定性 |
|
|
|
|
与H+的反应 |
|
|
|
|
铝热反应 |
|
|
|
|
俗名 |
|
|
|
|
用途 |
|
|
|
元素周期律和元素周期表是学习化学的一种重要工具,对整个中学化学的教学有着重大的指导作用,因此有关本部分的知识是高考必考的内容之一。热点内容主要集中在以下几个方面:一是元素周期律的迁移应用,该类题目的特点是:给出一种不常见的主族元素,分析推测该元素及其化合物可能或不可能具有的性质。解该类题目的方法思路是:先确定该元素所在主族位置,然后根据该族元素性质递变规律进行推测判断。二是确定“指定的几种元素形成的化合物”的形式,该类题目的特点是:给出几种元素的原子结构或性质特征,判断它们形成的化合物的形式。解此类题的方法思路是:定元素,推价态,想可能,得化学式。三是由“位构性”关系推断元素,该类题目综合性强,难度较大,一般出现在第Ⅱ卷笔答题中,所占分值较高。
元素周期律与元素周期表知识内容丰富,规律性强,因此命题的空间极为广阔。考查元素周期表的结构与元素性质的递变规律的试题,或以一组元素加以比较或以一种元素进行多方面的分析,具有一定的综合性,同时体现元素周期表的发现方法--分类方法的运用的试题,是高考试题中的精彩之笔;而在上海高考题中往往每年有一道与原子结构、元素周期表、元素性质相结合的推断题,这是上海试题中的一大特点。展望今后的题型会稳中有变,仍以元素及其化合物知识为载体,用物质结构理论,将解释现象、定性推断、归纳总结、定量计算相结合,向多方位、多角度、多层次方向发展。
[例题]在探索生命奥秘的过程中,科学家们日益认识到生命细胞的组成和元素周期律有着密切的关系。约占人体总质量99.97%的11种宏量元素,全部位于周期表前20号元素之内,其余0.03%是由10多种人体不可缺少的微量元素组成。在微量元素中,只有F和Si位于短周期,其余均属第一长周期。在宏量元素中,除H、N、P外,在现用周期表的其余元素中(写出元素符号):
(1)原子最外层电子数是最内层电子数2倍的是 。
(2)能显示化合价最多的元素是 ,跟它处在同一周期的还有一种非金属元素是___________。
(3)原子半径最大的是 ,它的相邻元素是 。
(4)剩余的两种元素,它们的离子电子层结构相同,且带电量也相同,但符号相反,这两种元素是 和 。
(5)氨基酸的主要组成元素为___________。
解析:题干给出了与生命科学相关的大量信息,需结合生物学知识和元素周期表知识正确解题。
答案:(1)C (2)Cl,S (3)K,Na、Ca (4)Mg,O (5)C、H、O、N
3.元素周期表中位置、结构、性质规律
(1)从元素周期表归纳电子排布规律
①最外层电子数等于或大于3(小于8)的一定是主族元素。
②最外层有1个或2个电子,则可能是ⅠA、ⅡA族元素又可能是副族或零族元素氦。
③最外层电子数比次外层电子数多的元素一定位于第二周期。
④某元素阴离子最外层电子数与次外层相同,该元素位于第三周期。
⑤电子层结构相同的离子,若电性相同,则位于同周期,若电性不同,则阳离子位于阴离子的下一周期。
(2)从元素周期表归纳元素化合价的规律
①主族元素的最高正价数等于主族序数,等于主族元素原子的最外层电子数,其中氟无正价。非金属元素除氢外,均不能形成简单阳离子,金属元素不能形成简单阴离子。
②主族元素的最高正价数与最低负价数的绝对值之和为8,绝对值之差为0,2,4,6的主族依次为ⅣA、ⅤA、ⅥA、ⅦA族。
③非金属元素的正价一般相差2,如氯元素正化合价有+7,+5,+3,+1等,某些金属也符合此规律,如锡元素正化合价有+4、+2价
④短周期正价变化随原子序数递增,同周期有一个+1到+7价的变化(ⅠA-ⅦA);长周期有两个+1到+7价的变化(ⅠA-ⅦB,ⅠB-ⅦA)。
(3)从元素周期表归纳元素形成单质的状态,形成晶体类型
①非金属单质最多的周期为第二周期(B、C、N2、O2、O3、F2等),最多的主族为ⅦA族(F2、Cl2、Br2、I2、At2)。
②只有非金属单质而无金属单质的主族为ⅦA族。
③常温下呈现气态的单质为H2、O2、F2、Cl2、N2、O3、He、Ne、Ar、Kr、Xe等。
④单质的晶体类型主要有金属晶体,分布在周期表梯子线(两区分界线)的左下方(氢除外);原子晶体分布在梯子线的附近(C、Si、B等);分子晶体分布在梯子线的右上方(N2、O2、F2、Ne等)。
2.由原子序数确定元素位置的规律
基本公式:原子序数-区域尾序数(10,18,36,54,86)=差值,对于18号以前的元素,若0<差值≤7时,元素在下一周期,差值为主族序数;若差值为0,则元素在尾序数所在的周期,一定为零族元素。对于19号以后的元素分三种情况:
(1)若差值为1-7时,差值为族序数,位于Ⅷ族左侧。
(2)若差值为8、9、10时,为Ⅷ族元素。
(3)若差值为11-17时,再减去10最后所得差值,即为Ⅷ族右侧的族序数。
1.原子结构与元素周期表关系的规律
(1)电子层数=周期数(电子层数决定周期数)
(2)最外层电子数=主族序数=最高正价数=价电子数
(3)核内质子数=原子序数
(4)负价绝对值=8-主族序数(限ⅣA-ⅦA)
(5)原子半径越大,失电子越易,还原性越强,金属性越强,形成的最高价氧化物的相应水化物碱性越强,其离子的氧化性越弱。
(6)原子半径越小,得电子越易,氧化性越强,非金属性越强,形成的气态氢化物越稳定,形成最高价氧化物的相应水化物酸性越强,其离子的还原性越弱。
30.答案:A:H B:O C:Na D:S
解析:由题意可知A、B、C、D在周期表中的位置可能为:
(1) (2)一周期A
二周期 A B 二周期 B
三周期 C D 三周期C D
若为(1),设核电荷数A=x,B=y,则
C=x+8, D=y+8
由题意得2(2x+8)=2y+8,得x= (4<y<10,x,y为正整数)
(4<y<10,x,y为正整数)
y=6, x=1(A为H不在二周期)不合理;y=8,x=2(A为He)也不合理。若为(2),则A为H,C为Na,由题意(1+11)×2=2y+8,y=8,即B为O,D为S,得解。
●命题趋向与应试策略
29.答案:
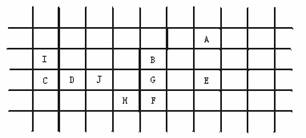
解析:本题考查了元素的性质随着原子序数(题中给元素相对原子质量)的递增而呈现周期性变化这一规律。解题时要充分利用表中数据,结合学习过的元素周期性变化:①同族金属元素(性质相似的金属元素)从上到下,熔点逐渐降低;②同周期的金属元素,从左到右,熔点逐渐升高。解题的方法技巧是:①确定元素种类:B、F、G、H属活泼金属;D、J属不活泼金属;C、I属非金属;A、E属稀有元素。②按元素的相对原子质量由小到大排列一横行;再把同类元素按相对原子质量自上而下排成一纵行;③结合表中已定位的A、B、H元素,确定其他元素的位置。
28.答案:(1)随着原子序数增大,E值变小 周期性
(2)①③ (3)485 738
(4)10号元素为氖。该元素原子的最外层电子排布已达到8电子稳定结构
解析:此题考查了元素第一电离能的变化规律和学生的归纳总结能力。
(1)从H、Li、Na、K等可以看出,同主族元素随元素原子序数的增大,E值变小;H到He、Li到.e、Na到Ar呈现明显的周期性。
(2)从第二、三周期可以看出,第ⅢA和ⅥA族元素比同周期相邻两种元素E值都低。由此可以推测E(砷)>E(硒)、E(溴)>E(硒)。
(3)根据同主族、同周期规律可以推测:E(K)<E(Ca)<E(Mg)。
(4)10号元素是稀有气体氖,该元素原子的最外层电子排布已达到8电子稳定结构。
27.答案:(1)n=2 m=4 (2)a=119
解析: =0.778……①
=0.778……①
 =0.636……②
=0.636……②
由①和②解得n/m=1/2,讨论得n=2 m=4,再把m或n代入①或②得a=119。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com