
12.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
3Zn+2K2FeO4+8H2O放电充电3Zn(OH)2+2Fe(OH)3+4KOH
下列叙述不正确的是( )
A.放电时负极反应为:3Zn+6OH-―→3Zn(OH)2+6e-
B.充电时阳极反应为:2Fe(OH)3+10OH-―→2FeO42-+8H2O+6e-
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
[解析] 放电时:负极为3Zn+6OH-―→3Zn(OH)2+6e-,正极为2FeO42-+6e-+8H2O―→2Fe(OH)3+10OH-,所以A、D正确,放电时每转移3 mol电子,正极有1 mol FeO42-即K2FeO4被还原;充电时:阴极:3Zn(OH)2+6e-―→3Zn+6OH-,阳极:2Fe(OH)3+10OH-―→2FeO42-+8H2O+6e-,B正确。
[答案] C
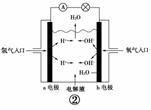
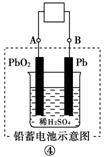
11.(2010年金华质检)有关下图装置的叙述不正确的是( )
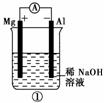

A.图①铝片发生的电极反应式是:Al+4OH-―→[Al(OH)4]-+3e-
B.图②b电极的电极反应式为:4OH-―→2H2O+O2↑+4e-
C.图③溶液中发生了变化:4Fe(OH)2+O2+2H2O===4Fe(OH)3
D.图④充电时,阳极反应是:PbSO4+2H2O―→PbO2+SO42-+4H++2e-
[解析] 图①中铝能与NaOH溶液自发反应,所以铝为负极,A项正确;图②为氢氧燃料电池,b电极为正极,氧气得到电子,B项错误;图③为铁的吸氧腐蚀,铁失去电子生成的Fe2+与溶液中的OH-结合形成Fe(OH)2,其不稳定继续被空气中的氧气氧化,C项正确;图④充电时,阳极与外接电源的正极相连,使PbSO4失去电子重新生成PbO2,D项正确。
[答案] B
10.已知下列热化学反应方程式:
Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g)
ΔH=-24.8 kJ/mol
Fe2O3(s)+CO(g)===Fe3O4(s)+CO2(g)
ΔH=-15.73 kJ/mol
Fe3O4(s)+CO(g)===3FeO(s)+CO2(g)
ΔH=+640.4 kJ/mol
则14 g CO气体还原足量FeO固体得到Fe固体和CO2气体时对应的ΔH约为( )
A.-218 kJ/mol B.-109 kJ/mol
C.+218 kJ/mol D.+109 kJ/mol
[解析] 该问题可以转化为CO(g)+FeO(s)===Fe(s)+CO2(g) ΔH=?所以应用盖斯定律,若把已知给出的3个热化学方程式按照顺序编号为①、②、③,那么[(①-②)×-③]×即可。
[答案] B
9.通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
|
化学键 |
H-H |
Cl-Cl |
H-Cl |
|
生成1 mol 化学键时 放出的能量 |
436 kJ·mol-1 |
243 kJ·mol-1 |
431 kJ·mol-1 |
则下列热化学方程式不正确的是( )
A.H2(g)+Cl2(g)===HCl(g) ΔH=-91.5 kJ·mol-1
B.H2(g)+Cl2(g)===2HCl(g) ΔH=-183 kJ·mol-1
C.H2(g)+Cl2(g)===HCl(g) ΔH=+91.5 kJ·mol-1
D.2HCl(g)===H2(g)+Cl2(g) ΔH=+183 kJ·mol-1
[解析] 本题考查反应热与键能的关系:ΔH=反应物键能总和-生成物键能总和。C项的反应是放热反应,C错误;ΔH=×436 kJ·mol-1-431 kJ·mol-1+×243 kJ·mol-1=-91.5 kJ·mol-1。
[答案] C
8.下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( )
①C(s)+O2(g)===CO2(g) ΔH1 C(s)+O2(g)===CO(g) ΔH2
②S(s)+O2(g)===SO2(g) ΔH3 S(g)+O2(g)===SO2(g) ΔH4
③H2(g)+O2(g)===H2O(g) ΔH5 2H2(g)+O2(g)===2H2O(g) ΔH6
④CaCO3(s)===CaO(s)+CO2(g) ΔH7 CaO(s)+H2O(l)===Ca(OH)2(s) ΔH8
A.① B.④
C.②③④ D.①②③
[解析] ①中C(s)完全燃烧反应放出的热量更多,ΔH1<ΔH2。②中S(g)燃烧放热更多,ΔH3>ΔH4。③中ΔH6=2ΔH5,反应放热,故ΔH5>ΔH6。④中ΔH7>0,ΔH8<0。
[答案] C
7.关于金属腐蚀的下列叙述中,不正确的是( )
A.铁器生锈、铜器长出“铜绿”、银制器皿表面变暗,都属于金属腐蚀
B.生铁比软铁芯(几乎是纯铁)容易生锈
C.铆在铜板上的铁钉在潮湿空气中容易生锈
D.家用炒菜铁锅用水清洗放置后出现的锈斑主要成分是Fe3O4
[解析] D项不正确,铁锈的主要成分是Fe2O3。
[答案] D
6.下列能说明锌比铜活泼的装置是( )
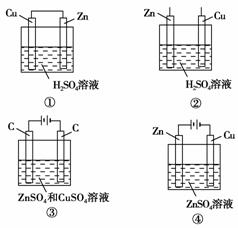
A.①③④ B.②③④
C.①②④ D.①②③
[解析] ①是原电池装置,Zn作负极,则金属活泼性Zn>Cu;②中Zn、Cu分别插入H2SO4溶液中,Zn与H2SO4反应而Cu不能反应,说明Zn比Cu活泼;③用惰性电极电解ZnSO4和CuSO4的混合溶液,Cu2+首先在阴极上放电,说明氧化性:Cu2+>Zn2+,则金属活泼性:Zn>Cu;④是电镀池,铜作阴极被保护,不能说明锌比铜活泼。
[答案] D
5.(2010年连云港质检)如下图,四种装置中所盛的溶液体积均为200 mL,浓度均为0.6 mol·L-1,工作一段时间后,测得导线上均通过了0.2 mol电子,此时溶液的pH由大到小的顺序是( )
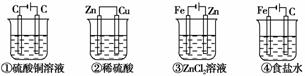
A.④②①③ B.④③①②
C.④③②① D.①③②④
[解析] 分析时注意电池类型及其所给量的限制。①为电解池,CuSO4未电解完,生成的H+等于转移电子数,n(H+)=0.2 mol;②为原电池:在正极2H++2e-―→H2↑,剩余H+为:0.2 L×0.6 mol/L×2-0.2 mol=0.04 mol;③为电镀池,电解质溶液浓度不变,呈弱酸性;④为电解池,放H2生碱型,溶液显碱性,故四者pH由大到小的顺序为④③②①,C项符合。
[答案] C
4.如下图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和NaCl的琼脂热溶液,冷却后形成琼胶(离子在琼胶内可以移动)。下列叙述正确的是( )
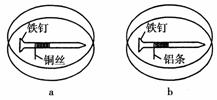
A.a中铁钉附近呈现红色 B.b中铁钉上发生还原反应
C.a中铜丝上发生氧化反应 D.b中铝条附近有气泡产生
[解析] 铁铜组成原电池铁作负极,铁铝组成原电池铁作正极。a中铁被氧化,正极铜丝周围氧气得电子发生还原反应,生成氢氧根离子使酚酞变红,b中铁钉上氧气得电子发生还原反应,生成氢氧根离子使酚酞变红,铝条失电子变为铝离子无气泡产生。
[答案] B
3.下列变化中,属于原电池反应的是( )
①在空气中金属铝表面迅速氧化形成保护层 ②白铁(镀锌)表面有划损时,也能阻止铁被氧化 ③红热的铁丝与水接触表面形成蓝黑色的保护层 ④铁与稀硫酸反应时,加入少量CuSO4溶液,可使反应加快
A.①② B.②③
C.③④ D.②④
[解析] ①金属铝表面迅速氧化形成致密的氧化物Al2O3薄膜,保护铝不再被腐蚀,不属于原电池反应;③3Fe+4H2O(g)高温,Fe3O4+4H2,Fe3O4为蓝黑色的保护膜,不属于原电池反应;②Zn较Fe活泼,一旦遇到电解质溶液时,Zn活泼失电子,保护铁,构成了原电池;④中发生反应Fe+CuSO4===FeSO4+Cu,构成Fe-稀H2SO4-Cu原电池,加快反应。
[答案] D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com