
7、设奇函数 在[-1,1]上是增函数,且
在[-1,1]上是增函数,且 ,若函数
,若函数 对所有的
对所有的 都成立,当
都成立,当 时t的取值范围为
时t的取值范围为
A、[-2,2] B、 C、
C、 D、
D、
6、已知函数 ,若
,若 ,则
,则 的取值范围为
的取值范围为
A、 B、
B、 C、
C、 D、
D、
5、函数 在(-1,1)上有定义且
在(-1,1)上有定义且 的取值范围为
的取值范围为
A、(-2,1) B、(0, )
C、(0,1)
D、(-2,
)
C、(0,1)
D、(-2, )
)
3、已知奇函数

 4、
4、 是定义在(0,3)上的函数,
是定义在(0,3)上的函数, 的图象如图所示,则不等式
的图象如图所示,则不等式 的解集 是
的解集 是
A.(0,1) (2,3)B.
(2,3)B.
C.(0,1)
 D.(0,1)
D.(0,1) (1,3)
(1,3)
2、已知 的取值范围为
的取值范围为
A、 B(0,1) C、(0,1)
B(0,1) C、(0,1)
 D、(0,1)
D、(0,1)

17.(12分)甲醛是一种重要的化工产品,可利用甲醇催化脱氢制备。甲醛与气态甲醇转化的能量关系如下图所示。
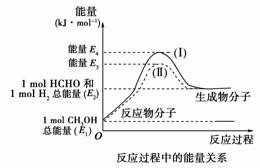
(1)甲醇催化脱氢转化为甲醛的反应是 (填“吸热”或“放热”)反应。
(2)过程Ⅰ与过程Ⅱ的反应热是否相同? 原因是________________________________________________________________________
________________________________________________________________________
。
(3)写出甲醇催化脱氢转化为甲醛的热化学反应方程式
________________________________________________________________________。
(4)甲醇催化脱氢转化为甲醛的过程中,如果要使反应温度维持在700 ℃,需向体系中通入空气,则进料甲醇与空气的物质的量理论比值为________[假设:H2(g)+O2(g)===H2O(g) ΔH=-a kJ·mol-1,空气中氧气体积分数为0.2]。
[答案] (1)吸热 (2)相同 一个化学反应的反应热仅与反应的起始状态和反应的最终状态有关,而与反应的途径无关
(3)CH3OH(g)HCHO(g)+H2(g)
ΔH=(E2-E1)kJ·mol-1
(4)
16.(10分)(2010年潍坊质检)如图甲、乙是电化学实验装置。
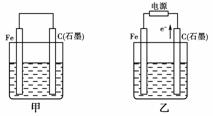
(1)若甲、乙两烧杯中均盛有NaCl溶液。
①甲中石墨棒上的电极反应式为______________________;
②乙中总反应的离子方程式为______________________;
③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。若反应中Cl2和I2的物质的量之比为5∶1,且生成两种酸,该反应的化学方程式为__________________。
(2)若甲、乙两烧杯中均盛有CuSO4溶液。
①甲中铁棒上的电极反应式为________________;
②如果起始时乙中盛有200 mL pH=5的CuSO4溶液(25 ℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入____________________(填写物质的化学式)________g。
[解析] (1)若两烧杯中均盛有NaCl溶液,则:①甲装置为原电池,石墨棒作正极,O2放电,电极反应为:O2+2H2O+4e-―→4OH-。②乙装置为电解池,石墨棒上发生氧化反应,Fe电极不参与反应,其实质与用惰性电极电解食盐水相同,离子方程式为2Cl-+2H2OCl2↑+H2↑+2OH-。③Cl2和I2的物质的量之比为5∶1,生成HCl和HIO3。(2)若两烧杯中均盛有CuSO4溶液,则:①甲装置为原电池,铁作负极,电极反应为:Fe―→Fe2++2e-。②乙装置为电解池,电解反应为:2CuSO4+2H2O2Cu+2H2SO4+O2↑,根据电解方程式,从电解质溶液中析出Cu,放出O2,因此只需加入CuO(或CuCO3)即可恢复到电解前的状态。由电解反应式可知,2H+-CuO-CuCO3,电解后n(H+)=0.1×0.2=0.02(mol),故m(CuO)=0.02××80=0.8(g),m(CuCO3)=0.02××124=1.24(g)。
[答案] (1)①O2+2H2O+4e-―→4OH-
②2Cl-+2H2O2OH-+H2↑+Cl2↑
③5Cl2+I2+6H2O===10HCl+2HIO3
(2)①Fe―→Fe2++2e- ②CuO(或CuCO3) 0.8(或1.24)
15.(10分)(2010年安庆质检)某课外活动小组准备用如图所示的装置进行实验。现有甲、乙、丙三位同学分别选择了如下电极材料和电解质溶液:
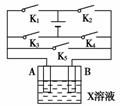
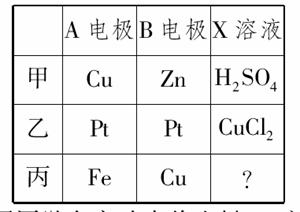
(1)甲同学在实验中将电键K5闭合,Zn电极上的电极反应式为________________________________________________________________________。
(2)乙同学准备进行电解CuCl2溶液的实验,则电解时的总反应方程式为________________________________________________________________________;
实验时应闭合的电键组合是 。(从下列五项中选择所有可能组合,第三小题也在这五项中选择)
A.K1和K2 B.K1和K3
C.K1和K4 D.K2和K3
E.K2和K4
(3)丙同学准备在Fe上镀Cu,选择了某种盐来配制电镀液,则该盐的化学式为____________,实验时,应闭合的电键组合是________(选项如上)。
[解析] (1)闭合K5后构成原电池,Zn为负极。
(2)将电源与题给装置构成闭合回路即可。
(3)电镀时,选择含镀层金属离子的溶液为电镀液,Fe应连接电源的负极,Cu连接电源的正极。
[答案] (1)Zn―→Zn2++2e-
(2)CuCl2Cu+Cl2↑ C、D
(3)CuCl2或CuSO4 D
14.(9分)如图装置,A、B中电极为多孔的惰性电极;C、D为夹在湿的Na2SO4滤纸条上的铂夹;电源有a、b两极。若在A、B中充满KOH溶液后倒立于KOH溶液的水槽中,切断K1,闭合K2、K3,通直流电,则:
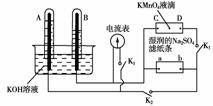
(1)标出电源的正、负极,a为 极。
(2)在湿的Na2SO4滤纸条中心的KMnO4液滴,有什么现象 。
(3)写出电极反应式:A中________________________________________________________________________。
(4)若电解一段时间,A、B中均有气体包围电极。此时切断K2、K3,闭合K1。电流表的指针偏转,则此时A极电极反应式为 。
[解析] 切断K1,闭合K2、K3时,在A、B、C、D电极上均发生电解反应。由图可知,B中产生的气体体积较大,故B应为阴极,故a为负极。滤纸上溶液中的电流方向应为D―→C。故紫色的MnO4-在电场的作用下会向阳极(D处)移动。
切断K2、K3,闭合K1后,会发生原电池反应。B中H2做负极,A中O2做正极。
[答案] (1)负 (2)紫色液滴向D处移动
(3)4OH-―→2H2O+O2↑+4e-
(4)O2+2H2O+4e-―→4OH-
13.(9分)(2010年瑞安质检)按要求写热化学方程式:
(1)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式________________________________________________________________________
__________________________。
(2) 25 ℃、101 kPa条件下充分燃烧一定量的丁烷气体放出热量为Q kJ,经测定,将生成的CO2通入足量澄清石灰水中产生25 g白色沉淀,写出表示丁烷燃烧热的热化学方程式
________________________________________________________________________。
(3)如图是101 kPa时氢气在氯气中点燃生成氯化氢气体的能量变化示意图:
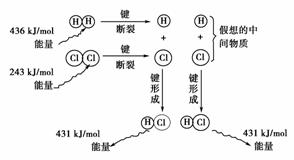
写出此反应的热化学方程式________________________________________________。
(4)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l)
ΔH1=-870.3 kJ/mol
②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ/mol
③H2(g)+O2(g)===H2O(l) ΔH3=-285.8 kJ/mol
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式____________________________________________。
[解析] (1)由中和热的定义可知,1 mol NaOH与 mol H2SO4生成1 mol水时放热57.3 kJ。
(2)CO2通入澄清石灰水中产生25 g白色沉淀,即n(CO2)=0.25 mol,则n(C4H10)= mol,1 mol 丁烷完全燃烧放出热量16Q kJ。
(3)1 mol H2与1 mol Cl2反应生成2 mol HCl的热效应是:
ΔH=436 kJ/mol+243 kJ/mol-2×431 kJ/mol=-183 kJ/mol。
(4)合成CH3COOH的反应为:
2C(s)+2H2(g)+O2(g)===CH3COOH(1)
根据盖斯定律,②×2+③×2-①即得,ΔH=(-393.5 kJ/mol)×2+(-285.8 kJ/mol)×2-(-870.3 kJ/mol)=-488.3 kJ/mol。
[答案] (1)H2SO4(aq)+NaOH(aq)===Na2SO4(aq)+H2O(1) ΔH=-57.3 kJ/mol
(2)C4H10(g)+O2(g)===4CO2(g)+5H2O(l)
ΔH=-16Q kJ/mol
(3)H2(g)+Cl2(g)===2HCl(g) ΔH=-183 kJ/mol
(4)2C(s)+2H2(g)+O2(g)===CH3COOH(l)
ΔH=-488.3 kJ/mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com