
21.(2010·杭州模拟)下列说法中正确的是( )
A.核外电子排布完全相同的两种微粒,其化学性质一定相同
B.同周期的主族元素从左到右,非金属性逐渐增强,气态氢化物稳定性逐渐增强
C.元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
D.原子最外层电子数大于4的元素一定是非金属元素
[解析]选BC。A项错误,如Na+和Ne核外电子排布相同,但化学性质不同;B项描述了同一周期元素性质的递变规律,正确;C项从ⅢB族到ⅡB族包括七个副族,占三个纵行的VⅢ族都是金属元素:C正确;D项最外层电子数大于4的元素如:Sn.Pb.Po.Bi等都是金属元素,故AD项错误。
20.(2010·河池模拟)短周期元素A、B、C原子序数依次递增,它们原子的最外层电子数之和为10。A与C在周期表中同主族,B原子最外层电子数等于A原子次外层电子数,则下列叙述正确的是( )。
A.原子半径A>B>C
B.A的氢化物的稳定性大于C的氢化物
C.B的氧化物的熔点比A的氧化物高
D.A与C可形成离子化合物
[解析]选BC。据题意可知B最外层电子数为2,则A、C最外层电子数为4.A、B、C原子序数递增,可推知A为C、B为Mg、C为Si,由此可判断。
19.(2010·宝鸡模拟)最近医学界通过用14C标记的C60发现一种C60的羟酸衍生物,在特定条件下可以通过断裂DNA抑制艾滋病毒的繁殖,则有关14C的正确叙述是( )。
A.与12C60的碳原子化学性质不同
B.与14N含的中子数相同
C.是12C60的同素异形体
D.与12C、13C互为同位素
[解析]选D。14C是由碳元素的一种同位素,原子核内有14-6=8个中子。12C60是碳元素原子组成的单质,与金刚石、石墨等属于同素异形体。同位素原子的中子数不同,但最外层电子数相同,故化学性质几乎完全相同。
18.(2010·杭州模拟)某酸根离子RO3-所含电子数比硝酸根离子NO3-的电子数多10,则下列说法正确的是( )。
①R原子的电子层数比N原子的电子层数多1 ②RO3-中R元素与NO3-中N元素的化合价相同 ③RO3-与NO3-只可能被还原,不可能被氧化 ④R和N不是同周期元素,但是同主族元素
A.①③④ B.①②④ C.①② D.③④
[解析]选C。RO3-比NO3-电子数多10,则R元素的一个原子比N元素一个原子多10个电子,即R元素的原子序数为17,Cl元素有3个电子层,比N原子多1个电子层,①正确;在ClO3-中的Cl元素与NO3-中N元素的化合价皆为+5价,②正确;
ClO3-中+5价氯元素,化合价既可升高又可降低,故③不正确;Cl元素位于第ⅦA族,N元素位于ⅤA族,显然④不正确。
17.(2010·宝鸡模拟)氯的原子序数为17,35Cl是氯的一种同位素,下列说法正确的
是( )。
A.35Cl原子所含质子数为18
B. mol的1H35Cl分子所含中子数约为6.02×1023
mol的1H35Cl分子所含中子数约为6.02×1023
C.3.5g的35Cl2气体的体积为1.12L
D.35Cl2气体的摩尔质量为70
[解析]选B。质子数=原子序数=17,A选项错误;1个1H35Cl分子含中子数为(0+35-17)=18个,所以 mol的该分子所含的中子数=
mol的该分子所含的中子数= mol×18×NA≈6.02×1023,B选项正确;气体摩尔体积必须在标况下为22.4L/mol,C选项错误;35Cl2摩尔质量为70g/mol,D选项错误。
mol×18×NA≈6.02×1023,B选项正确;气体摩尔体积必须在标况下为22.4L/mol,C选项错误;35Cl2摩尔质量为70g/mol,D选项错误。
16.(2010·余杭模拟)正确掌握好化学用语是学好化学的基础,下列有关表述正确的
是( )。
①CO2的比例模型:
②O原子的结构示意图:
③聚乙烯的结构简式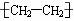
④次氯酸的结构式:H-Cl-O
⑤NH3的电子式: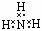
⑥明矾的化学式KAlSO412H2O
⑦作为相对原子质量测定标准的碳核素: C
C
⑧碳酸氢根离子的电离方程式:HCO3-+H2O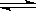 H3O++CO32-
H3O++CO32-
⑨铝热反应:2Al+3MgO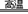 Al2O3+3Mg
Al2O3+3Mg
⑩Fe3O4溶于氢碘酸的离子方程式:Fe3O4+8H+ 2Fe3++Fe2++4H2O
2Fe3++Fe2++4H2O
A.⑧ B.除⑥⑦外 C.除③⑥⑦⑨外 D.①④⑧⑨⑩
[解析]选A。碳原子的半径比氧原子的大,所以CO2的比例模型中应该是中间的球比两边的球大,①错误;O原子的结构示意图为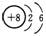 ,图中给的是其电子层结构示意图,②错误;聚乙烯是高分子化合物,其结构简式中漏掉了右下角的n,③错误;O可以形成2个共价键,而H和Cl只能形成1个共价键,所以次氯酸的结构式应为:
,图中给的是其电子层结构示意图,②错误;聚乙烯是高分子化合物,其结构简式中漏掉了右下角的n,③错误;O可以形成2个共价键,而H和Cl只能形成1个共价键,所以次氯酸的结构式应为:
H-O-Cl,④错误;NH3的电子式中漏掉了N原子的孤对电子,正确的电子式为: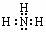 ,⑤错误;明矾的化学式是:KAl(SO4)2·12H2O,⑥错误;
,⑤错误;明矾的化学式是:KAl(SO4)2·12H2O,⑥错误; C作为相对原子质量测定标准,⑦错误;HCO3-电离显酸性,有H+或H3O+生成,水解显碱性,有
C作为相对原子质量测定标准,⑦错误;HCO3-电离显酸性,有H+或H3O+生成,水解显碱性,有
OH-生成,⑧正确;铝热反应是金属铝和比它不活泼的金属氧化物之间发生的置换反应,Mg比Al活泼,该反应不能发生,⑨错误;Fe3+具有氧化性,能够将氢碘酸中的
I-氧化成I2,⑩错误,其正确的离子方程式为:Fe3O4+8H++2I- 3Fe2++I2+4H2O。
3Fe2++I2+4H2O。
15.(2010·铜陵模拟)某元素最高价含氧酸的化学式为HxROy,则气态氢化物的化学式( )。
A.H8+x-2yR B.H8(2x+y)R C.H2x+8+yR D.RH8+x-2y
[解析]选AD。根据中性微粒化合价之和为0,元素的最高正价与最低负价的绝对值之和等于8求,由化学式HxROy可知,R的最高化合价为+(2y-x)价,则其最低负价为-[8-(2y-x)]=-(8+ x-2y)价。若R为VIA~VIIA族元素,则其气态氢化物的化学式为H8+x-2yR,若R为IVA~VA族元素,则其气态氢化物的化学式为
RH8+x-2y。
14.(2010·银川模拟)据已有知识和元素性质递变规律来判断下列比较正确的是( )。
A.第二周期氢化物易燃性:CH4<NH3<H2O
B.第三周期氢化物稳定性:SiH4>PH3>H2S>HCl
C.化合物毒性:若PH3>NH3,则H2S>H2O
D.氢化物的还原性:HF>H2O>NH3>CH4
[解析]选C。采用同一主族和同一周期元素的性质的“递变性”来归纳推导。甲烷容易燃烧,而水不容易燃烧,可以推知“同一周期元素从左向右,氢化物的易燃性越来越弱”,A选项错误;根据同一周期元素从左向右,非金属性逐渐增强,氢化物的稳定性逐渐增强,氢化物的还原性逐渐减弱,B、D选项错误;若毒性PH3>NH3,说明“同一主族元素从上向下,氢化物的毒性越来越强”,C选项正确。
13.(2010·青州模拟)有三种短周期元素,最外层电子数之和为17,质子数之和为31。如果这三种元素中有一种是氩元素,则关于另外两种元素的说法不正确的是( )。
A.如果一种元素是金属元素,则另一种元素一定是稀有元素
B.如果一种元素的单质通常情况下是气体,则另一种元素的单质通常情况下是固体
C.如果一种元素的气态氢化物是三角锥形分子,则另一种元素的气态氢化物一定是正四面体形分子
D.如果一种元素的最高正价是+3,则另一种元素的单质有两种常见的同素异形体
[解析]选AC。由题所给信息可知,除氩以外的另两种短周期元素最外层电子数之和为9,质子数之和为13,可知内层电子数和为4,均为第二周期,可能为Li、Ne;Be、F;B、O;C、N组合。若一种是金属元素,另一种可能是Ne,也可能是氟,A不正确;B中一种是气体,另一种可能是Li、Be、B、C通常状况下是固体;C中气态氢化物是三角锥分子,是NH3,另一种元素的气态氢化物可以是CH4或其它气态烃,C不正确;D中最高价为正三价,是B元素,另一种元素是O元素,存在O2和O3两种常见同素异形体。
12.(2010·上海黄浦区模拟)X、Y、Z是原子序数依次递增的三种短周期元素。X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层电子数的三倍,Y和Z可以形成两种以上气态化合物。则下列说法一定正确的是( )。
A.其中有硫元素 B.其中有金属元素
C.这三种元素能够组成盐 D.这三种元素均位于不同周期
[解析]选C。根据X原子的电子层数与它的核外电子总数相同可推断X为氢元素。根据Z原子的最外层电子数是次外层电子数的三倍可推断Z为氧元素。根据X、Y、Z原子序数依次递增、Y和Z可以形成两种以上气态化合物,可推断Y、Z同在第二周期,D选项错误;Z应为氮元素,三种元素能够组成硝酸铵(铵盐是唯一的全部由非金属元素组成的盐),C选项正确。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com