
19.放在水平地面上的一物块,受到方向不变的水平推力F的作用,F的大小与时间t的关系和物块速度v与时间t 的关系如图所示。取重力加速度g=10m/s2。由此两图线可以求得物块的质量m和物块与地面之间的动摩擦因数μ分别为 ( )
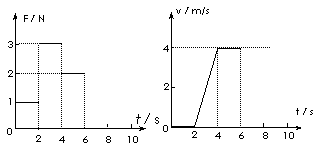
A.m=0.5kg,μ=0.4
B.m=1.5kg,μ=
C.m=0.5kg,μ=0.2 D.m=1kg,μ=0.2
18.磕头虫是一种不用足跳但又善于跳高的小甲虫。当它腹朝天、背朝地躺在地面时,将头用力向后仰,拱起体背,在身下形成一个三角形空区,然后猛然收缩体内背纵肌,使重心迅速向下加速,背部猛烈撞击地面,地面反作用力便将其弹向空中。弹射录像显示,磕头虫拱背后重心向下加速(视为匀加速)的距离大约为0.8mm,弹射最大高度为24cm。而人原地起跳方式是,先屈腿下蹲,然后突然蹬地向上加速,假想加速度与磕头虫加速过程的加速度大小相等,如果加速过程(视为匀加速)重心上升高度为0.5m,那么人离地后重心上升的最大高度可达(空气阻力不计,设磕头虫撞击地面和弹起的速率相等)( )
A.150m B.75m C.15m D.7.5m
17.如图所示,光滑水平面上放置质量分别为m、2m和3m的三个木块,其中质量为2m和3m的木块间用一不可伸长的轻绳相连,轻绳能承受的最大拉力为T。现用水平拉力F拉其中一个质量为3m的木块,使三个木块以同一加速度运动,则以下说法正确的是 ( )
 A.质量为2m的木块受到四个力的作用
A.质量为2m的木块受到四个力的作用
B.当F逐渐增大到T时,轻绳刚好被拉断
C.当F逐渐增大到 时,轻绳还不会被拉断
时,轻绳还不会被拉断
D.轻绳刚要被拉断时,质量为m和2m的木块间的摩擦力为
16.如图所示,一物块置于水平地面上.当用与水平方向成 角的力
角的力 拉物块时,物块做匀速直线运动;当改用与水平方向成
拉物块时,物块做匀速直线运动;当改用与水平方向成 角的力
角的力 推物块时,物块仍做匀速直线运动.若
推物块时,物块仍做匀速直线运动.若 和
和 的大小相等,则物块与地面之间的动摩擦因数为 ( )
的大小相等,则物块与地面之间的动摩擦因数为 ( )
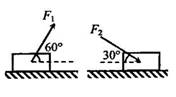
A、 B、
B、 C、
C、 D、1-
D、1-
15.轻质弹簧的上端固定在电梯的天花板上,弹簧下端悬挂一个小球,电梯中有质量为50kg的乘客如图6所示,在电梯运行时乘客发现轻质弹簧的伸长量是电梯静止时的一半,取g=10m/s2这一现象表明( ).
A. 电梯此时可能正以1m/s2的加速度大小加速上升,也可能是以1m/s2加速大小减速上升
B. 电梯此时不可能是以1 m/s2的加速度大小减速上升,只能是以5 m/s2的加 速度大小加速下降
C. 电梯此时可能正以5m/s2的加速度大小加速上升,也可能是以5m/s2大小的加速度大小减速下降
D.不论电梯此时是上升还是下降,加速还是减速,乘客对电梯地板的压力大小一定是250N
14.一辆汽车在水平路面上以速度为15m/s时开始刹车,刹车时所受的阻力是车重的0.5倍。g=10rn/s2。则刹车后第一个2 s和第二个2 s内的位移之比是( )
A.8:l B.5:l C.4:l D.3:l
25.(2010·金华模拟)A、B、C、D四种短周期元素的原子序数依次增大,A元素的气态氢化物与A元素的最高价氧化物对应的水化物能反应生成盐;B、C、D同周期,它们的最高价氧化物对应的水化物两两之间都能反应生成盐和水,B和D可组成化合物BD。回答下列问题:
(1)A元素的气态氢化物的结构式为:__________。D的最高价氧化物对应水化物的化学式:____________。
(2)在工业上常用________法制备单质C(填金属的冶炼方法)
(3)C、D组成的化合物溶于水的离子方程式:_________________。
(4)B、C最高价氧化物对应的水化物在溶液中反应的离子方程式为:_____________。
[解析]分析元素周期表和各元素的性质:A元素的气态氢化物与A元素的最高价氧化物对应的水化物能反应生成盐,可知A是N元素(NH3+HNO3=NH4NO3)。B、C、D同周期,它们的最高价氧化物对应的水化物要么是酸,要么是碱,且两两之间都反应生成盐和水,可知C为Al;又B和D可组成BD化合物,可推得B为Na,D为Cl,由此可顺利解题。
[答案](1)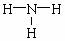 HClO4
HClO4
(2)电解;
(3)Al3++3H2O Al(OH)3+3H+;
Al(OH)3+3H+;
(4)Al(OH)3+OH-=AlO2-+2H2O
|
|
24.(2010·启东模拟)W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生盐和水,该反应的离子方程式为______________________________________________________。
(2)W与Y可形成化合物W2Y,该化合物的电子式为_________。
(3)X的硝酸盐水溶液显______性,用离子方程式解释原因__________________。
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为_________。
(5)比较Y、Z气态氢化物的稳定性:_________>_________(用分子式表示)。
(6)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是:
_________>_________>_________>_________。
(7)Z的最高价氧化物为无色液体,0.25mol该物质与一定量水混合得到一种稀溶液,并放出QkJ的热量。写出该反应的热化学方程式__________________。
[解析](1)W、X为金属,其最高价氧化物对应的水化物为碱,且两种碱可以反应生成盐和水,则为NaOH和Al(OH)3,二者反应的离子方程式:Al(OH)3+OH-=
AlO2-+2H2O。
(2)W为Na,W可以和Y形成W2Y,则Y为-2价,为ⅥA元素,且和钠同周期,所以为S。W2Y为Na2S,电子式为: 。
。
(3)Y的硝酸盐为Al(NO3)3,由于Al3+的水解:Al3++3H2O Al(OH)3+3H+,其溶液呈酸性。
Al(OH)3+3H+,其溶液呈酸性。
(4)Y的低价氧化物为SO2;并且Z和Y同周期,原子序数比Y大,所以Y为Cl。Y的低价氧化物和Z的单质反应的方程式:SO2+Cl2+2H2O=H2SO4+2HCl。
(5)非金属性越强,气态氢化物的稳定性越强;由于非金属性:Cl>S,所以气态氢化物的稳定性:HCl>H2S。
(6)对电子层结构相同的单核离子,核电荷数越大,则离子半径越小,10电子离子半径比较关系有:r(N3-)>r(O2-)>r(F-)>r(Na+)>r(Mg2+)>r(Al3+);18电子离子半径比较关系有:r(S2-)>r(Cl-)>r(K+)>r(Ca2+);同族离子电子层数越多,离子半径越大,r(Cl-)>r(F-),综合上述关系得出:r(S2-)>r(Cl-)>r(Na+)>r(Al3+)。
(7)Z的最高价氧化物为Cl2O7是酸性氧化物,与水反应生成对应的酸:Cl2O7+H2O=2HClO4,0.25mol Cl2O7放出QkJ的热量,故△H<0,对应的热化学方程式为:Cl2O7(l)+H2O(l)=2HClO4(aq) △H=-4QkJ/mol。
[答案](1)Al(OH)3+OH-=AlO2-+2H2O (2) 。
。
(3)酸;Al3++3H2O Al(OH)3+3H+
;(4)SO2+Cl2+2H2O=H2SO4+2HCl ;(5)HCl>H2S
Al(OH)3+3H+
;(4)SO2+Cl2+2H2O=H2SO4+2HCl ;(5)HCl>H2S
(6)r(S2-)>r(Cl-)>r(Na+)>r(Al3+)
(7)Cl2O7(l)+H2O(l)=2HClO4(aq);△H=-4QkJ/mol。
23.(2010·苏州模拟)下表给出了五种元素的相关信息,其中A、B、C、D为短周期元素。
|
元素 |
相关信息 |
|
A |
在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为倍受青睐的清洁燃料。 |
|
B |
工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障。 |
|
C |
植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂。 |
|
D |
室温下其单质呈粉末状固体,加热易熔化。该单质在氧气中燃烧,发出明亮的蓝紫色火焰。 |
|
E |
它是人体不可缺少的微量元素,其单质也是工业生产中不可缺少的金属原材料,常用于制造桥梁、轨道等。 |
根据上述信息填空:
(1)B在元素周期表中的位置是__________,画出D的原子结构示意图__________。
(2)D的单质与烧碱水溶液加热时自身的氧化还原反应生成两种具有强还原性的阴离子,写出该反应的离子方程式____________________。
(3)C与A形成的某一化合物能和C与B形成的另一无色化合物(这两种化合物分子中原子个数比皆为1∶2)一起用作火箭助推剂,写出两者发生反应生成无毒物质的化学方程式________________________________________。
(4)某矿藏主要含D、E两种元素组成的化合物,它是我国生产某强酸的主要原料。试写出该生产过程中第一阶段主要反应的化学方程式_________________________。
(5)以上这五种元素能组成一种工业上用途极广的复盐(含一种阴离子和多种阳离子),该物质中的A、B、C、D、E的质量比为5∶56∶7∶16∶14。请写出该化合物的化学式__________________。其水溶液的pH_____7(填“>”、“=”或“<”)。
[解析]氢气是一种清洁燃料,所以A为氢元素;臭氧对紫外线有吸收作用,是保护地球地表环境的重要屏障,所以B为氧元素;氮磷钾是植物生长三要素,N2O俗名“笑气”,是早期医疗中使用的麻醉剂,所以C为氮元素;单质硫在氧气中燃烧,发出明亮的蓝紫色火焰,所以D为硫元素;日常生产和生活中最常用的金属是铁、铜和铝,其中只有铁是人体不可缺少的微量元素,所以E为铁元素。(2)能够在碱性溶液中存在的含硫的阴离子有S2-、SO32-和SO42-,前二者具有强还原性,所以单质硫与烧碱溶液加热时生成Na2S和Na2SO3。(3)氮和氢形成的原子个数比为1∶2的化合物为N2H4,氮和氧形成的原子个数比为1∶2的化合物有NO2和N2O4,其中N2O4是无色气体,NO2是红棕色气体,N2H4和N2O4反应生成的无毒的N2和H2O。(4)我国主要以黄铁矿(主要成分是FeS2)为原料制备硫酸,其第一阶段主要反应是煅烧黄铁矿。(5)n(H)∶n(O)∶
n(N)∶n(S)∶n(Fe)= ∶
∶ ∶
∶ ∶
∶ ∶
∶ =20∶14∶2∶2∶1,其两种阳离子只可能是2个NH4+和1个Fe2+或Fe3+,阴离子只能是2个SO42-,根据电荷守恒判断阳离子只可能是Fe2+,根据质量守恒定律判断剩余12个氢原子应该以6个水的形式存在,所以其化学式为:(NH4)2Fe(SO4)2·6H2O,NH4+和1个Fe2+水解都显酸性,所以其溶液的pH<7。
=20∶14∶2∶2∶1,其两种阳离子只可能是2个NH4+和1个Fe2+或Fe3+,阴离子只能是2个SO42-,根据电荷守恒判断阳离子只可能是Fe2+,根据质量守恒定律判断剩余12个氢原子应该以6个水的形式存在,所以其化学式为:(NH4)2Fe(SO4)2·6H2O,NH4+和1个Fe2+水解都显酸性,所以其溶液的pH<7。
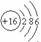 [答案](1)第二周期第VIA族
[答案](1)第二周期第VIA族
(2)3S+6OH- SO32-+2S2-+3H2O
SO32-+2S2-+3H2O
(3)N2H4+N2O4 3N2+4H2O
3N2+4H2O
(4)4FeS2+11O2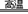 2Fe2O3+8SO2
2Fe2O3+8SO2
(5)(NH4)2Fe(SO4)2·6H2O <
22.(2010·南通模拟)W、X、Y、Z是原子序数依次增大的同一短周期元素,W是金属元素,X是地壳中含量最多的金属元素,且W、X的最高价氧化物的水化物相互反应生成盐和水;Y、Z是非金属元素,Y与W可形成离子化合物W2Y;G在Y的前一周期,其原子最外层比Y原子最外层少1个电子。
(1)X的原子结构示意图为_____________________。
(2)W、X的最高价氧化物的水化物相互反应的离子方程式为______________。
(3)工业上制取X单质的化学方程式为____________________________。
(4)G的气态氢化物与Y的最高价氧化物的水化物恰好反应生成的正盐溶液中,离子浓度由大到小的顺序为___________________________________。在催化剂作用下,汽车尾气中G的氧化物GO与一氧化碳两种气体能相互反应转化为无污染、能参与大气循环的两种气体,若有33.6L(已换算成标准状况)一氧化碳参加反应,转移的电子数为_______mol。
(5)298K时,Z的最高价氧化物为无色液体,0.25mol该物质与一定量水混合得到Z的最高价氧化物的水化物的稀溶液,并放出akJ的热量。该反应的热化学方程式为________________________________________________________。
(6)实验室制备Y的单质时,常用排WY的饱和溶液法进行收集,其理由是(请结合化学平衡理论简要分析说明)______________________________________。
[解析]地壳中含量最多的金属元素是Al,W的最高价氧化物的水化物能够和
Al(OH)3反应生成盐和水,所以W为Na元素,Y与W可形成离子化合物W2Y,说明Y显-2价,所以Y为S元素,其最外层有6个电子,G最外层有5个电子,为N元素。Z的原子序数比Y的大,所以Z为Cl元素。
[答案](1)
(1)Al(OH)3+OH-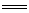 AlO2-+2H2O或Al(OH)3+OH-
AlO2-+2H2O或Al(OH)3+OH-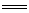 [Al(OH)4]-
[Al(OH)4]-
(3)2A12O3(熔融) 4Al+3O2↑
4Al+3O2↑
(4)c(NH4+)>c(SO42-)>c(H+)>c(OH-) 3
(5)Cl2O7(l)+H2O(1)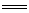 2HClO4(aq) △H=-4akJ·mol
-1
2HClO4(aq) △H=-4akJ·mol
-1
(6)在氯水中存在如下平衡:Cl2+H2O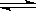 H++Cl-+HClO,在饱和NaCl溶液中,
H++Cl-+HClO,在饱和NaCl溶液中,
c(Cl-)最大,该平衡逆向移动程度最大,Cl2溶解的最少,所以可以用饱和NaCl溶液法收集Cl2。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com