
1.对下列句中加粗词,解释有误的一组是[ ]
A.徘徊于斗牛之间 斗牛:斗宿,牛宿,都是星宿名。
B.纵一苇之所如 如:往
C.渺渺兮予怀 予:我
D.方其破荆州 方:刚
3.联系实际,综合应用
卤素知识与现代生产、日常生活、医疗保健、科学技术等各方面有着广泛的联系,如海洋资源的开发与利用、氯碱工业、漂白粉应用、饮用水消毒、氟与人体健康、碘与甲状腺肿、碘化银与人工降雨等。这些内容既能与化学基本理论、其他元素化合物知识、化学实验和化学计算融为一体;又能与电学等物理学知识、激素调节等生物学知识密切相关,常作为进行学科间相互综合、相互渗透考查的内容载体。所以卤素与实际相联系的知识必将是今后高考命题的热点之一。
[例题]碘缺乏症遍及全球,多发生于山区,南美的安第斯山区、欧洲的阿尔卑斯山区和亚洲的喜马拉雅山区是高发病地区。我国云南、河南等10余省的山区发病率也较高。据估计我国患者大约有1000万人。为控制该病的发生,较为有效的方法是食用含碘食盐。我国政府以国家标准的方式规定在食盐中添加碘酸钾(KIO3)。据此回答下列问题。
(1)碘是合成下列哪种激素的主要原料之一
A.胰岛素 B.甲状腺激素 C.生长激素 D.雄性激素
(2)长期生活在缺碘山区,又得不到碘盐的供应,易患
A.甲状腺亢进 B.佝偻病
C.地方性甲状腺肿 D.糖尿病
(3)可用盐酸酸化的碘化钾和淀粉检验食盐中的碘酸钾。反应的化学方程式为 ,氧化产物与还原产物的物质的量之比为_________,能观察到的明显现象是 。
(4)已知KIO3可用电解方法制得。原理是:以石墨为阳极,以不锈钢为阴极,在一定电流强度和温度下电解KI溶液。总反应化学方程式为:KI+3H2O KIO3+3H2↑,则两极反应式分别为:阳极
,阴极
。
KIO3+3H2↑,则两极反应式分别为:阳极
,阴极
。
(5)在某温度下,若以12 A的电流强度电解KI溶液10min,理论上可得标况下氢气 L。
解析:此题重点考查了一些卫生保健的常识及与其有关的化学知识。碘是合成甲状腺激素的主要原料之一,缺碘易患地方性甲状腺肿,这一病症可用食含碘食盐的方法来预防。这些内容属于卫生保健的常识性知识。但检验食盐中是否含碘及如何制取碘盐中所需的KIO3,则需用化学知识来解决。在酸性条件下,IO 可氧化I-生成单质碘,碘遇淀粉变为蓝色,反应的化学方程式为:5KI+KIO3+6HCl===6KCl+3I2+3H2O,I2既是氧化产物,又是还原产物,其物质的量之比为5∶1。
可氧化I-生成单质碘,碘遇淀粉变为蓝色,反应的化学方程式为:5KI+KIO3+6HCl===6KCl+3I2+3H2O,I2既是氧化产物,又是还原产物,其物质的量之比为5∶1。
电解KI溶液时,在阳极放电的是I-,电极方程式为I-+3H2O-6e-===IO +6H+,在阴极放电的是水电离出的H+,电极方程式为:6H2O+6e-===3H2↑+6OH-。
+6H+,在阴极放电的是水电离出的H+,电极方程式为:6H2O+6e-===3H2↑+6OH-。
本题的第(5)小题是利用电学知识解决化学问题。依据Q=It和1个电子的电量为1.60×10-19C,n(e-)= =7.475×10-2 mol,V(H2)=
=7.475×10-2 mol,V(H2)= mol×22.4 L·mol-1=0.837 L。
mol×22.4 L·mol-1=0.837 L。
答案:(1)B (2)C
(3)5KI+KIO3+6HCl===6KCl+3I2+3H2O 5∶1 溶液变蓝
(4)I-+3H2O-6e-===IO +6H+
6H2O+6e-===3H2↑+6OH-
+6H+
6H2O+6e-===3H2↑+6OH-
(5)0.837
2.卤素性质的迁移应用
对卤素性质迁移应用能力的考查已成为相当稳定的一个题型,主要考查学生的分析能力,适应新情境的能力及知识迁移应用能力。该类题目的特点是:给出类卤素如(CN)2、(SCN)2、IBr等的性质与卤素相似,或给出新的知识情境,然后依据卤素的性质结合具体的实例进行迁移应用。在进行迁移应用时,既要注意“类卤素”与卤素的相似性,即表现在单质的氧化性、与碱溶液反应生成卤化物和次卤酸盐、与Ag+结合的生成物的难溶性等。又要注意“类卤素”与卤素明显的差异性,即由于类卤素的组成不是一种元素,其各元素的化合价有差别,以致在参加化学反应中价态的变化与卤素单质不完全相同,如:IBr+H2O===HBr+HIO的反应不属于氧化还原反应等。
卤素是典型的非金属元素,历来是高考的必考内容,其主要热点是:
1.卤素及其化合物的性质
既有对某一具体知识点考查的选择题,又有与其元素(如铁、硫等)或者与电解氯化钠溶液相结合组成框图的物质推断题,还有对卤素性质、制法、用途等全面考查的综合题,尤其是以氯气的性质及其实验室制取装置为基础的实验题,曾多次出现在高考试题中。因此要掌握氯及其化合物的性质、氯气的实验室制法,卤素的相似性和递变性。
3.卤素的特殊性
(1)碘单质遇淀粉显示出蓝色,该性质可用于检验Cl2,Cl2可使湿润的KI淀粉试纸变蓝,实质是:Cl2+2I-===I2+2Cl-。I2再作用于淀粉显示出蓝色,另外碘单质还易升华。
(2)氢氟酸能腐蚀玻璃(4HF+SiO2===SiF4↑+2H2O),因此,氢氟酸必须保存在塑料试剂瓶中,制备HF时,反应必须在铅制器皿中进行。
(3)氯气具有漂白性,其实质是Cl2与H2O反应生成的次氯酸(HClO)具强氧化性使有机色质褪色,次氯酸是一种强氧化性的弱酸。
2.卤素化学性质的相似性和递变性
(1)卤素是典型的非金属元素,其元素的非金属性强弱顺序为:F>Cl>Br>I
(2)卤素单质均是氧化剂,其氧化能力强弱顺序为:F2>Cl2>Br2>I2
(3)卤离子均具还原性,其还原性强弱顺序为:I->Br->Cl->F-
(4)卤素单质均能与氢化合,但反应条件不同,生成的气态氢化物稳定性亦不相同。
F2+H2 2HF H2+Cl2
2HF H2+Cl2 2HCl Br2+H2
2HCl Br2+H2 2HBr I2+H2
2HBr I2+H2 2HI
2HI
气态氢化物稳定性大小顺序为:HF>HCl>HBr>HI
(5)卤素单质均可与水反应,但反应难易程度不同。
2F2+2H2O===4HF+O2↑(剧烈反应)
Cl2+H2O===HCl+HClO(反应较慢)
2HClO===2HCl+O2↑
Br2+H2O===HBr+HBrO(反应微弱)
I2与H2O只有很微弱的反应。
(6)卤素单质可与碱溶液发生自身氧化还原反应生成-1价卤化物和+1价或+5价卤酸盐。
Cl2+2NaOH===NaCl+NaClO+H2O
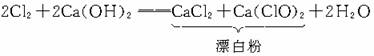
3Br2+6NaOH===5NaBr+NaBrO3+3H2O
(7)AgX除AgF外均不溶于水,不溶于酸。
(8)AgCl、AgBr、AgI均不稳定,见光发生分解反应,生成卤素单质及银。
2AgX 2Ag+X2
2Ag+X2
(9)氢卤酸的水溶液均呈酸性,除HF是弱酸外,其余均为强酸,其酸性相对强弱顺序为:HI>HBr>HCl>HF。
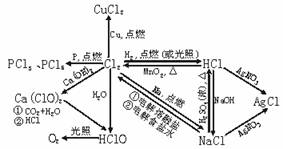
1.氯气及其化合物间的转化关系
氯的代表性中包含了卤素的相似性,掌握了氯气及其化合物的性质,就能推广出卤素的相似性,这是学好卤素的关键。有关氯气及其化合物的相互转化关系见下表:
22.答案:BrO +5Br-+6H+===3Br2+3H2O m/80 氧化 m/16 Br-
+5Br-+6H+===3Br2+3H2O m/80 氧化 m/16 Br-
解析:根据同一元素不同价态间反应可生成中间价态的物质得出反应式;然后利用相对分子质量及化学计量数可顺利解决此问题。
●命题趋向与应试策略
21.答案:(1)HCl (2)Cl2+2NaOH===NaCl+NaClO+H2O

解析:本题综合考查了氯气的性质、电解饱和食盐水、氨气的合成等三个方面的内容,是MCE94无机框图题的再现,但难度有所下降,解决此题的关键是氯气的性质的应用,知道氯气与NaOH反应有三种产物,与H2反应有一种产物,本题即可突破。解此题另一关键点是题目所给的一组数据,由此推出C、D、I反应的化学计量数之比,从而得出该反应为合成氨反应。定性判断与定量推断相结合解无机框图题是今后命题的一个方向。
20.答案:合格
解析:I2+2S2O ===2I-+S4O
===2I-+S4O
n(I2)=0.03 mol·L-1×0.018 L×1/2=0.27×10-3 mol
IO +5I-+6H+===3I2+3H2O
+5I-+6H+===3I2+3H2O
n(KIO3)=0.27×10-3 mol×1/3=0.09×10-3 mol
每千克食盐中含KIO3: ×1000 mg·g-1=45 mg
×1000 mg·g-1=45 mg
所以该加碘食盐是合格的。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com