
1.复数的加法运算及几何意义
①.复数的加法法则: ,则
,则 。
。
例 1.计算(1)
1.计算(1) (2)
(2)
 (3)
(3)
(4)
②.观察上述计算,复数的加法运算是否满足交 换、结合律,试给予验证。
换、结合律,试给予验证。
例2.例1中的(1)、(3)两小题,分别标出 ,
, 所对应的向量,再画出求和后所对应的向量,看有所发现。
所对应的向量,再画出求和后所对应的向量,看有所发现。
③复数加法的几何意义:复数的加法可以按照向量的加法来进行(满足平行四边形、三角形法则)
3. 同时用坐标和几
同时用坐标和几 何形式表示复数
何形式表示复数 所对应
所对应 的向量,并计算
的向量,并计算
 。向量的加减运算满足何种法则?[来源:学*科*网Z*X*X*K]
。向量的加减运算满足何种法则?[来源:学*科*网Z*X*X*K]
4. 类比向量坐标形式的加减运算,复数的加减运算如何?
2. 试判 断下列复数
断下列复数 在复平面中落在哪象限?并画出其对应的向量。
在复平面中落在哪象限?并画出其对应的向量。
1. 与复数一一对应的有?
7、 产品绿色化:产品的使用不8、 会引起生态危害、不9、 会威胁人类健康、可循环利用。
课堂练习:
6 20世纪90年代,国际上提出了“预防污染”的根本手段,它的目标是研究和寻找能充分利用的无毒害原材料,最大限度地节约能源,在化工生产各环节能都实现净化和无污染的反应途径。下列各项属于“绿色化学”的是 A.处理废弃物 B.治理污染点 C.减少有毒物 D.杜绝污染源
7
在“绿色化学工艺”中,理想状 态是反应物中原子全部都转化为欲制得的产物,即原子利用率为100%。在用CH3C≡CH合成CH2=C(CH3)COOCH3的过程中,欲使原子利用率达到最高,还需要的其它反应物有
A.CO和CH3OH B.CO2和H2O C.H2和CO2 D.CH3OH和H2[来源:学+科+网Z+X+X+K]
态是反应物中原子全部都转化为欲制得的产物,即原子利用率为100%。在用CH3C≡CH合成CH2=C(CH3)COOCH3的过程中,欲使原子利用率达到最高,还需要的其它反应物有
A.CO和CH3OH B.CO2和H2O C.H2和CO2 D.CH3OH和H2[来源:学+科+网Z+X+X+K]
8
绿色化学对化学反应提出了 “原子经济性”的新概念及要求。理想的原子经济性反应是原料分子中的原子全部转变成所需产物,不产生副产物,实现零排放。以下反应中符合绿色化学原理的是
A.乙烯与氧气在银催化作用下生成环氧乙烷 B.乙烷与氯气制备氯乙烷
C.苯和乙醇为原料,在一定条件下生产乙苯 D.乙醇与浓硫酸共热制备乙烯
“原子经济性”的新概念及要求。理想的原子经济性反应是原料分子中的原子全部转变成所需产物,不产生副产物,实现零排放。以下反应中符合绿色化学原理的是
A.乙烯与氧气在银催化作用下生成环氧乙烷 B.乙烷与氯气制备氯乙烷
C.苯和乙醇为原料,在一定条件下生产乙苯 D.乙醇与浓硫酸共热制备乙烯
9
在“绿色化学工艺”中,理想状态是反应物中的原子全部转化为欲制得的产物,即原子利用率为100%。下列反应类型能体现“原子经济性”原则的是
①置换反应 ②化合反应 ③分解反应 ④取 代反应 ⑤加成反应⑥消去反应 ⑦加聚反应
⑧缩聚反应
A.①②⑤ B.②⑤⑦
代反应 ⑤加成反应⑥消去反应 ⑦加聚反应
⑧缩聚反应
A.①②⑤ B.②⑤⑦ C.只有⑦⑧ D.只有⑦
C.只有⑦⑧ D.只有⑦
10
有效地利用现有能源和开发新能源已受到各国的普遍重视.
(1)可用改进汽油组成的办法来改善汽油的燃烧性能.例如,加入CH3OC(CH3)3来生产“无铅汽油”.CH3OC(CH3)3分子中必存在的原子间连接形式有__________(填写编号,多选倒扣).
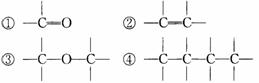 (2)天然气的燃烧产物无毒、热值高、管道输送方便,将成为我国西部开发的重点之一,天然气常和石油伴生,其主要的成分是________.能说明它是正四面体而非正方形平面
(2)天然气的燃烧产物无毒、热值高、管道输送方便,将成为我国西部开发的重点之一,天然气常和石油伴生,其主要的成分是________.能说明它是正四面体而非正方形平面 结构的理由是__________(填写编号,多选倒扣).
①其一氯取代物不存在同分异构体 ②其二氯取代物不存在同分异构体
③它是非极性分子 ④它的键长和键角都相等
(3)1980年我国首次制成一辆燃氢汽车,乘员12人,以50km·h-1行驶了40km.为了有效发展用氢能源
结构的理由是__________(填写编号,多选倒扣).
①其一氯取代物不存在同分异构体 ②其二氯取代物不存在同分异构体
③它是非极性分子 ④它的键长和键角都相等
(3)1980年我国首次制成一辆燃氢汽车,乘员12人,以50km·h-1行驶了40km.为了有效发展用氢能源 ,首先必须制得廉价的氢气.下列可供开发又较经济的制氢方法是__________(填写编号,多选倒扣)。 ①电解水 ②锌和稀硫酸反应 ③光解海水
其次,制得纯氢气后还需要解决的问题是__________(写出其中一个).
,首先必须制得廉价的氢气.下列可供开发又较经济的制氢方法是__________(填写编号,多选倒扣)。 ①电解水 ②锌和稀硫酸反应 ③光解海水
其次,制得纯氢气后还需要解决的问题是__________(写出其中一个).
11
为了做好环境污染的防治工作,我们每一个公民必须努力增强环境意识:一方面要清醒地认识到人类在开发和利用___ __________的过程中,往往对生态环境造成__________
__________的过程中,往往对生态环境造成__________ 和_________,另一方面要把这种认识转变为________
和_________,另一方面要把这种认识转变为________ __,以“__________、__________”的态度积极参加各项环境保护活动,自觉培养____________________。
__,以“__________、__________”的态度积极参加各项环境保护活动,自觉培养____________________。
12 污水处理厂对污水进行处理时,一方面利用_________等方法,除去工业污水和生活污水中个体比较大的固体污染物;另一方面利用_________。把污水中的有机物分解成CO2、、H2O以及含氮和含磷的无机盐等,使污水得到净化。
13
环境监测测定水中溶氧的方法是:①量 取amL水样,迅
取amL水样,迅 速加入固定剂MnSO4溶液和碱性KI溶液(含有KOH),立即塞好瓶塞,反复振荡,使之充分反应,其反应式为:2Mn2++O2+4OH-=2MnO(OH)2(该反应极快)。②测定:开塞后迅速加入12mL浓H2SO4(提供H+)使之生成I2,再用bmol/L的Na2S2O3溶液与之反应(以淀粉为指示剂),消耗VmL,有关反应方程式为:MnO(OH)2+2I-+4H+=Mn2++I2+8H2O I2+2S2O32-=2I-+S4O62-,水中溶氧的计算式是 。
速加入固定剂MnSO4溶液和碱性KI溶液(含有KOH),立即塞好瓶塞,反复振荡,使之充分反应,其反应式为:2Mn2++O2+4OH-=2MnO(OH)2(该反应极快)。②测定:开塞后迅速加入12mL浓H2SO4(提供H+)使之生成I2,再用bmol/L的Na2S2O3溶液与之反应(以淀粉为指示剂),消耗VmL,有关反应方程式为:MnO(OH)2+2I-+4H+=Mn2++I2+8H2O I2+2S2O32-=2I-+S4O62-,水中溶氧的计算式是 。
14 含有氰化物的废水危害极大,能毒杀各种鱼类和水生物。[CN-]离子浓度在0.01-0.04mgL-1时就有强烈的毒杀作用,处理含有氰化物的工业废水的方法之一是:使CN-被氧化转变为低毒的CNO-,一般地转化为氰酸盐(如NaCNO)。氧化剂常用次氯酸盐,同时还可降解产生无毒气体。近期表明,在光的作用下,在某些悬浮小粒表面和溶液界面可发生明显的氧化还原反应,很快降解毒性,如在二氧化钛(TiO2)表面上可以降解氰化物等有毒物。 (1)二氧化钛在上述反应中的作用是什么? (2)如果用NaClO处理含NaCl的废液,则可能生成另外两种盐(毒性降解),试写出此反应的化学方程式: 。 (3)氰酸盐再与次氯酸盐作用降解产生的无毒气体有哪些?写出可能发生的离子方程式。

6、 溶剂绿色化:溶剂要低污染、低残留、溶解性强。如:超临界二氧化碳或液态二氧化 碳、离子液体等。
碳、离子液体等。
4、 催化剂绿色化:选用无毒、无污染、可重复5、 使用的高效催化剂。如分子筛、酶等。
1、 原料绿色化:用可再生资源(农业 性、生物性)原料,2、 替代不3、 可再生性原料。
性、生物性)原料,2、 替代不3、 可再生性原料。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com