

3.非金属单质的聚集状态和同素异形体:
①典型的非金属单质在固态时为分子晶体,如:F2、Cl2、Br2、I2、O2、S、N2、P4、H2,这些晶体表现为硬度不大,熔点不高,易挥发、不导电,它们在常温下聚集态为气态(“气”字头)液态(“氵”旁)或固态(“石”字旁)
②碳(金刚石)、硅、硼为原子晶体,硬度很大,熔沸点很高。由于原子晶体中没有离子和自由电子,所以固态和熔融态都不导电。但某些原子晶体,如单晶硅可以作为半导体材料。
③非金属元素常出现同素异形现象。如:金刚石与石墨;白磷与红磷;O2与O3;S2、S4、S8等互为同分异构体。
2。原子结构特点及化合价:
Ⅰ.最外层电子均大于、等于3(除H以外),与其主族序数相同。
Ⅱ.最高正价分别为:+4 +5 +6 +7(与族序数相等)
对应最低负价:-4 -3 -2 -1(等于族序数减8)
Ⅲ.非金属元素一般都有变价:除呈现上述最高价及最低价以外,有的非金属还呈现其它价态。如:
S:+4价;N:+1 +2 +3 +4价; Cl:+1 +3 +5价。
1.位置:在已知的元素中,非金属共22种(包括6种稀有气体元素),除氢元素位于周期表的ⅠA族外,其余都集中在元素周期表阶梯线(硼、硅、砷、碲、砹斜线)的右上方。
2.外内:
(1)浓度:浓度越大,单位体积内活化分子数 ,有效碰撞的几率 ,发生化学反应的速率 ;因此,化学反应速率与浓度有密切的关系,浓度越大,化学反应速率越快。增大反应物的浓度,正反应速率加快。
(2)温度:温度越高,一方面活化分子百分数 ,另一方面含有较高能量的分子间的碰撞频率 ,两个方面都使分子间有效碰撞的几率 ,反应速率 (正逆反应速率都加快)。
(3)压强:对于有气体参与的化学反应,通过改变容器体积而使压强变化的情况(PV=nRT):压强增大,相当于浓度 ,反应速率 。(反应物和生成物的浓度都增大,正逆反应速率都增大,相反,亦然)。
(4)催化剂:使用正催化剂,反应所需的活化能 ,活化分子百分数 ,有效碰撞的几率 ,化学反应速率 (对于可逆的反应使用催化剂可以同等程度地改变正逆反应速率)。
试题枚举
[例1]已知:4NH3+5O2 4NO+6H2O,若反应速率分别用υ(NH3)、υ(O2)、υ(NO)、υ(H2O)
[mol·L-1·min-1]表示,则关系正确的是
4NO+6H2O,若反应速率分别用υ(NH3)、υ(O2)、υ(NO)、υ(H2O)
[mol·L-1·min-1]表示,则关系正确的是
A.4υ(NH3)=5υ(O2) B. 5υ(O2)=6υ(H2O)
C. 3υ(NH2)=2υ(H2O) D. 4υ(O2=5υ(NO)
解析:化学反应方程式的系数与分别用各物质表达的化学反应速率成正比。
答案:C、D
[变式]在2L密闭容器中,发生3A(气)+B(气)=2C(气)的反应,若最初加入A和B都是4mol,A的平均反应速率为0.12mol/L·s,则10秒钟后容器中B的物质的量为
A.2.8mol B.1.6mol C.3.2mol D.3.6mol
答案:C
[例2]某温度时,浓度都是1mol·L-1的两种气体,X2、Y2在密闭容器中反应生成气体Z,达到平衡时c(X2)=0.4mol·L-1、c(Y2)=0.8mol·L-1、c(Z)=0.4mol·L-1,则该反应的反应式是
A. X2+2Y2  2XY2 B. 2X2+Y2
2XY2 B. 2X2+Y2
 2X2Y
2X2Y
C. 3X2+Y2 2X3Y D. X2+3Y2
2X3Y D. X2+3Y2
 2XY3
2XY3
解析:根据化学反应方程式的系数与分别用各物质表达的化学反应速率成正比的关系,只需分别计算同一时间内用各物质表达的化学反应速率,然后进行比较。
答案:C
[变式]A和B反应生成C,假定反应由A、B开始,它们的起始浓度均为1mol/L。反应进行2min后A的浓度为0.8mol/L,B的浓度为0.6mol/L,C的浓度为0.6mol/L。则2min内反应的平均速率υA=__________,υB=_____________,υC=___________。该反应的化学反应方程式为___________________________。
答案υA=0.1mol·L-1·min-1, υB=0.2mol·L-1·min-1, υC=0.3mol·L-1·min-1;
化学反应方程式为A+2B=3C。
[例3]在一定条件下,反应N2+3H2
 2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为
2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为
A. υ(H2)=0.03mol/(L·min) B. υ(N2)=0.02mol/(L·min)
C. υ(NH3)=0.17g/(L·min) D. υ(NH3)=0.01mol/(L·min)
解析:根据题目可知V(NH3)=0.01mol/(L·min),根据反应系数与化学反应速率的关系可求出V(H2)=0.015mol/(L·min)
答案:D
[变式]4NH3+5O2
 4NO+6H2O反应在5L的密闭容器中进行,半分钟后,NO物质的量增加了0.3mol,则此反应的反应速率为
4NO+6H2O反应在5L的密闭容器中进行,半分钟后,NO物质的量增加了0.3mol,则此反应的反应速率为
A.υ(O2)=0.01mol/L·s B.υ(NO)=0.008mol/L·s
C.υ(H2O)=0.003mol/L·s D.υ(NH3)=0.002mol/L·s
答案:CD
[变式]把0.6molX气体和0.4molY气体混合2L于容器中使它们发生如下反应,3X(气)+Y(气) nZ(气)+2W(气),5min末已生成0.2mol W,若测知以Z浓度变化来表示的反应平均速率为0.01mol/L·min,则
(1)上述反应中Z气体的反应方程式系数n的值是
A.1 B.2 C.3 D.4
(2)上述反应在5分钟末时,已消耗的Y值占原来的分数是
A.20% B.25% C.33% D.50%
答案:(1)A (2)B
[例4]下列体系加压后,对化学反应速率没有影响的是
A.2SO2+O2  2SO3 B.CO+H2O(气)
2SO3 B.CO+H2O(气)  CO2+H2
CO2+H2
C.CO2+H2  H2CO3 D.OH-+H+=H2O
H2CO3 D.OH-+H+=H2O
解析:压强对没有气体参加的反应无影响。
答案:D
[例5]把镁带投入盛有盐酸的敞口容器里,在下列因素中:①盐酸的浓度,②镁带的表面积,③溶液的温度,④氯离子的浓度。对反应速率有影响的是
A.①② B.③④ C.①②③④ D.①②③
解析:根据影响反应速率的因素有:浓度、温度、压强和催化剂可知,①③肯定对反应速率有影响,而镁带的表面积越大则与盐酸的接触越充分,显然反应速率越快。此反应的实质是Mg+2H+=Mg2++H2↑,与氯离子浓度无关,所以④对此反应速率无影响。故本题的正确答案为D。
答案:D
1.内因: (如:钠与水反应和钾与水反应速率明显不同)。
3.相互关系:
4NH3+5O2 4NO+6H2O(g)
4NO+6H2O(g)
υ(NH3)∶υ(O2)∶υ(NO)∶υ(H2O)=4∶5∶4∶6
2.单位:mol/(L·s);mol/(L·min);mol/L·S。
用单位时间里反应物浓度的减少或生成物浓度的增加来表示。
1.表示方法:υ=△c/△t
40.(27分)中华人民共和国成立以来,中国共产党领导全国各族人民沿着社会主义道路进行了不懈的探索。回答下列问题。
中国共产党把坚持马克思主义基本原理同推进马克思主义中国化结合起来,开辟了中国特色社会主义道路。中国特色社会主义道路的探索过程,是我们党在实践基础上不断深化对共产党执政规律、社会主义建设规律和人类社会发展规律认识的过程,是创造性地探索和回答一系列重大理论与实际问题的过程(如图14),是中国特色社会主义理论体系的形成过程。
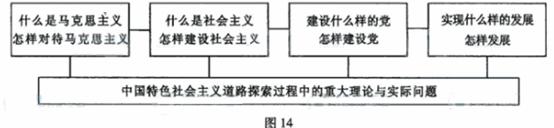
(1) 运用哲学常识中关于规律的相关知识,说明中国特色社会主义道路的探索过程。(11分)
中华人民共和国六十年的外交历程,就是冲破各种阻力走向世界,与各种不同类型国家逐步建立友好合作关系的历史。
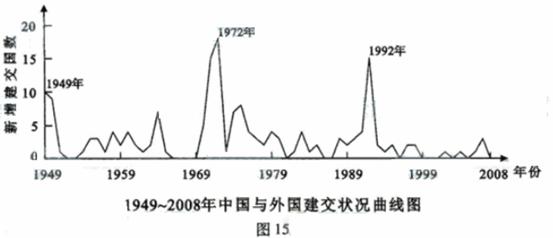
(2) 中华人民共和国成立以来 ,形成了1949年、1972年和1992年三次与外国建交的高峰(见图15)。请从中任选一次,指出促成该次建交高峰的国内外因素。(8分)
(注:本题要求只选三次建交高峰中的一次,若选答多项,只评阅所答第一项。)
1980年以来中国对外开放空间的扩展,是探索建设中国特色社会主义道路的体现。
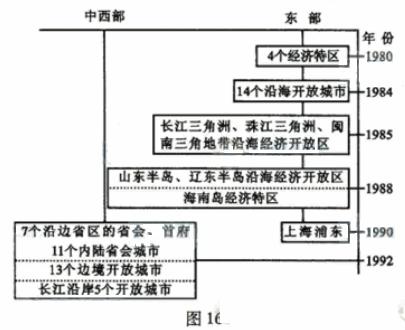
(3)读图16,概述中国对外开放空间扩展的过程。(8分)



湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com