
1.推测某些元素的性质:常见的题型是给出一种不常见的主族元素或尚未发现的主族元素,要我们根据该元素所在族的熟悉元素的性质,根据相似性与递变规律,加以推测。
主族元素的周期序数= ;主族序数= = ;
│主族元素的负化合价│=8-主族序数
长式元素周期表在编排时将 排在一行,将 排在一列;元素周期表共 个周期,分为 个短周期, 个长周期,第七周期未排满,称为不完全周期;元素周期表共 纵行,分为 个族,其中主族、副族各 个,另有 和 。元素周期表中元素的“外围电子排布”又 称 ,按其差异可将周期表分为 、 、 、 、 五个区, 、 区的元素统称为过渡元素。
思考:1。一、二、三、四周期各包含几种元素?
2.一、二、三、四周期上下相邻的元素核电荷数之差可能是多少?找出其中的规律。
29.(07年理综北京卷·27)(17分)某课外小组对一些金属单质和化合物的性质进行研究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
|
实验步骤 |
实验现象 |
|
将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中 |
产生气泡,析出疏松的红色固体,溶液逐渐变为无色 |
|
反应结束后分离出溶液备用 |
|
|
红色固体用蒸馏水洗涤后,置于潮湿空气中 |
一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3] |
按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式)
置换反应____________________________________;
化合反应____________________________________。
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡。持续电解,在阴极附近的溶液中还可观察到的现象是_________________________________________。解释此现象的离子方程式是___________________________________________________________。
(3)工业上可用铝与钦锰矿(主要成分为MnO2)反应来冶炼金属锰。
①用铝与软锰矿冶炼锰的原理是(用化学方程式表示)_______________________________。
②MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化后的H2O2溶液中,MnO2溶解产生Mn2+,该反应的离子方程式是______________________________________。
28.(2007年高考理综山东卷·29)(15分)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式_______________________________。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。
正极反应____________________________,负极反应_____________________________。
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤____________________。
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Fe3+ |
1.9 |
3.2 |
|
Fe2+ |
7.0 |
9.0 |
|
Cu2+ |
4.7 |
6.7 |
|
提供的药品:Cl2、浓H2SO4、NaOH溶液、CuO、Cu |
(4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀。
有关反应的化学方程式_________________________、_________________________。
劣质不锈钢腐蚀的实验现象_________________________________________________。
27.(11分)(08年海南化学·29)如何防止铁的锈蚀是工业上研究的重点内容。为研究铁锈蚀的影响因素,某同学做了如下探究实验:
|
序号 |
内容 |
实验现象 |
|
1 |
常温下将铁丝放在干燥空气中一个月 |
干燥的铁丝表面依然光亮 |
|
2 |
常温下将铁丝放在潮湿空气中一小时 |
铁丝表面依然光亮 |
|
3 |
常温下将铁丝放在潮湿的空气中一个月 |
铁丝表面已变得灰暗 |
|
4 |
将潮湿的铁丝放在常温的氧气流中一小时 |
铁丝表面略显灰暗 |
|
5 |
将潮湿的铁丝放在高于常温的氧气流中一小时 |
铁丝表面已变得灰暗 |
|
6 |
将浸过氯化钠溶液的铁丝放在高于常温的氧气流中一小时 |
铁丝表面灰暗程度比实验5严重 |
回答以下问题:
(1)上述实验中发生了电化学腐蚀的是(填实验序号) ;在电化学腐蚀中,负极反应是 ;正极反应是 。
(2)由该实验可知,可以影响铁锈蚀速率的因素是 。
(3)为防止铁的锈蚀,工业上普遍采用的方法是 (答两种方法)。
26.(10分)(08年海南化学·16)现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。已知实验中可能会发生下列反应:
①2Mg+O2 2MgO;②3Mg+N2
2MgO;②3Mg+N2  Mg3N2;③2Mg+CO2
Mg3N2;③2Mg+CO2 2MgO+C;
2MgO+C;
④Mg+H2O MgO+H2↑;⑤Mg3N2 +6H2O =3Mg(OH)2↓+2NH3↑
MgO+H2↑;⑤Mg3N2 +6H2O =3Mg(OH)2↓+2NH3↑
可供选择的装置和药品如下图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。
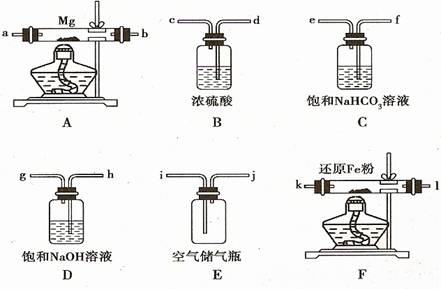
回答下列问题;
(1)在设计实验方案时,除装置A、E外,还应选择的装置(填字母代号)及其目的分别 。
(2)连接并检查实验装置的气密性。实验开始时,打开自来水的开关,将空气从5升的储气瓶压入反应装置,则气流流经导管的顺序是(填字母代号) 。
(3)通气后,如果同时点燃A、F装置的酒精灯,对实验结果有何影响? ,原因是 。
(4)请设计一个实验,验证产物是氮化镁: 。
25.(8分)(08年江苏化学·16)根据下列框图回答问题(答题时,方程式中的M、E用所对应的元素符号表示):

(1)写出M溶于稀H2SO4和H2O2混合液的化学方程式: 。
(2)某同学取X的溶液,酸化后加入KI、淀粉溶液,变为蓝色。写出与上述变化过程相关的离子方程式: 、 。
(3)写出Cl2将Z氧化为K2EO4的化学方程式: 。
24.(11分)(08年广东化学·22)
铜在自然界存在于多种矿石中,如:
|
矿石名称 |
黄铜矿 |
斑铜矿 |
辉铜矿 |
孔雀石 |
|
主要成分 |
CuFeS2 |
Cu5FeS4 |
Cu2S |
CuCO3·Cu(OH)2 |
请回答下列问题:
(1)上表所列铜化合物中,铜的质量百分含量最高的是 。
(2)工业上以黄铜矿为原料。采用火法溶炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S 6Cu+SO2↑,反应的氧化剂是 。
6Cu+SO2↑,反应的氧化剂是 。
(3)SO2尾气直接排放到大气中造成环境污染的后果是 ;处理该尾气可得到有价值的化学品,写出其中1种酸和1种盐的名称 。
(4)黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制。请简述粗铜电解得到精铜的原理: 。
(5)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是 (填字母)。
|
选项 |
陈述Ⅰ |
陈述Ⅱ |
判断 |
|
A |
铜绿的主成分是碱酸铜 |
可用稀盐酸除铜器表面的铜绿 |
Ⅰ对;Ⅱ对;有 |
|
B |
铜表易形成致密的氧化膜 |
铜容器可以盛放浓硫酸 |
Ⅰ对;Ⅱ对;有 |
|
C |
铁比铜活泼 |
例在铜板上的铁钉在潮湿空气中不易生锈 |
Ⅰ对;Ⅱ对;有 |
|
D |
蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是物理变化 |
硫酸铜溶液可用作游泳池的消毒剂 |
Ⅰ错;Ⅱ对;无 |
23.(14分)(08年宁夏理综·26)
某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。
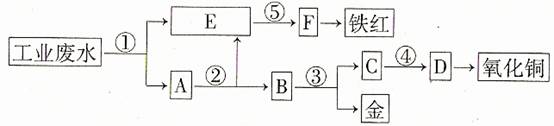
填写下面空白。
(1)图中标号处需加入的相应物质分别是① 、② 、③ 、④ 、⑤ ;
(2)写出①处发生反应的离子方程式 ;写出③处发生反应的化学方程式 ;
(3)铁红的化学式为 ;分别写出铁红和氧化铜在工业上的一种主要用途:铁红 ;氧化铜 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com