
2.下面语段中有两处语病,找出并在原句中改正。(2分)
毕业前的日子,时间过的好像流沙,看起来漫长,却无时无刻在逝去。未来就像天空中一朵飘忽不定的云彩,而从毕业这一天起,便开始了漫长的追逐云彩的旅程。
1.根据拼音写汉字,给加点的字注音。(2分)
90年前,五四运动的爆发,像一道闪电,撕裂了zhì息的黑暗;像一点星燧,引燃了燎原的烈焰。直到今天,五四运动的爱国主义光芒仍灼灼其华,烛照神州,激励青年。
① zhì ② 灼
11.(09四川卷27)(15分)已知A-O分别代表一种物质,它们之间的转化关系如下图所示(反应条件略去)。A、B、H分别是由短周期元素组成的单质。B与冷水缓慢反应,与沸水迅速反应,放出氢气。D是一种离子化合物,其阴阳离子的个数比为2:3,且能与水反就应得到两种碱。C为淡黄色固体化合物,O能与G的水溶液反应生成蓝色沉淀。
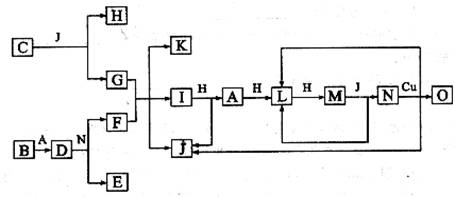
请回答下列问题:
(1)组成B单质的元素位于周期表第______________周期,第_______________族。化合物C的电子式为_________________________。
(2)J的沸点比硒化氢(H2Se)的沸点高,其原因是_________________。
(3)写出I与H在点燃条件下反应生成A和J的化学方程式:________________。
(4)写出D与足量的N反应生成E和F的化学方程式:_____________________。
(5)上图中,在同一反应里一种物质作氧化剂,又作还原剂,这样的反应共有_______个。
10.(09北京卷27)(14分)某学习小组探究浓、稀硝酸氧化性的相对强弱的,按下图装置进行试验(夹持仪器已略去)。实验表明浓硝酸能将 氧化成
氧化成 ,而稀硝酸不能氧化
,而稀硝酸不能氧化 。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
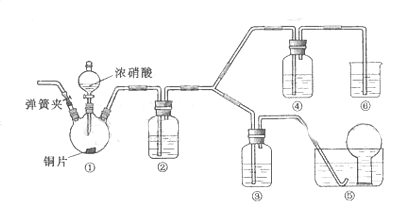
可选药品:浓硝酸、3mo/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与 反应,能与
反应,能与 反应
反应

(1) 实验应避免有害气体排放到空气中,装置③、④、⑥中乘放的药品依次是
(2) 滴加浓硝酸之前的操作时检验装置的气密性,加入药品,打开弹簧夹后
(3) 装置①中发生反应的化学方程式是
(4) 装置②的作用是 ,发生反应的化学方程式是
(5) 该小组得出的结论依据的试验现象是
(6) 试验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别涉及了一下4个试验来判断两种看法是否正确。这些方案中可行的是(选填序号字母)
a. 加热该绿色溶液,观察颜色变化
b. 加水稀释绿色溶液,观察颜色变化
c. 向该绿色溶液中通入氮气,观察颜色变化
d. 向饱和硝酸铜溶液中通入浓硝酸与铜反映产生的气体,观察颜色变化
答案: (1)3mol/L稀硝酸、浓硝酸、氢氧化钠溶液
(1)3mol/L稀硝酸、浓硝酸、氢氧化钠溶液
 (2)通入CO2一段时间,关闭弹簧夹,将装置⑤中导管末端伸入倒置的烧瓶内
(2)通入CO2一段时间,关闭弹簧夹,将装置⑤中导管末端伸入倒置的烧瓶内
 (3)Cu + 4HNO3(浓)= Cu(NO3)2 + 2NO2↑ + 2H2O
(3)Cu + 4HNO3(浓)= Cu(NO3)2 + 2NO2↑ + 2H2O
 (4)将NO2转化为NO 3NO2 +
H2O =2HNO3 + NO
(4)将NO2转化为NO 3NO2 +
H2O =2HNO3 + NO
 (5)装置③中液面上方气体仍为无色,装置④中液面上方气体由无色变为红棕色
(5)装置③中液面上方气体仍为无色,装置④中液面上方气体由无色变为红棕色
 (6)a c d
(6)a c d
 [解析]本题主要考查HNO3的性质、化学基本实验设计和评价能力。(1)根据装置特点和实验目的,装置⑤是收集NO,装置⑥中盛放NaOH溶液吸收NO2,因为要验证稀HNO3不能氧化NO,所以装置③中应该盛放稀硝酸。
[解析]本题主要考查HNO3的性质、化学基本实验设计和评价能力。(1)根据装置特点和实验目的,装置⑤是收集NO,装置⑥中盛放NaOH溶液吸收NO2,因为要验证稀HNO3不能氧化NO,所以装置③中应该盛放稀硝酸。
 (2)由于装置中残存的空气能氧化NO而对实验产生干扰,所以滴加浓HNO3之前需要通入一段时间CO2赶走装置中的空气,同时也需将装置⑤中导管末端伸入倒置的烧瓶内防止反应产生的NO气体逸出。
(2)由于装置中残存的空气能氧化NO而对实验产生干扰,所以滴加浓HNO3之前需要通入一段时间CO2赶走装置中的空气,同时也需将装置⑤中导管末端伸入倒置的烧瓶内防止反应产生的NO气体逸出。
 (3)Cu与浓HNO3反应生成Cu(NO3)2、NO2、H2O:Cu + 4HNO3(浓)=Cu(NO3)2 + 2NO2↑ +2 H2O。
(3)Cu与浓HNO3反应生成Cu(NO3)2、NO2、H2O:Cu + 4HNO3(浓)=Cu(NO3)2 + 2NO2↑ +2 H2O。
 (4)装置②中盛放H2O,使NO2与H2O反应生成NO:3NO2 + H2O=2HNO3 + NO。
(4)装置②中盛放H2O,使NO2与H2O反应生成NO:3NO2 + H2O=2HNO3 + NO。
 (5)NO通过稀HNO3溶液后,若无红棕色NO2产生,说明稀HNO3不能氧化NO,所以盛放稀HNO3装置的液面上方没有颜色变化即可说明之。装置④中盛放的是浓HNO3,若浓HNO3能氧化NO则装置④液面的上方会产生红棕色气体。
(5)NO通过稀HNO3溶液后,若无红棕色NO2产生,说明稀HNO3不能氧化NO,所以盛放稀HNO3装置的液面上方没有颜色变化即可说明之。装置④中盛放的是浓HNO3,若浓HNO3能氧化NO则装置④液面的上方会产生红棕色气体。
 (6)要证明是Cu(NO3)2浓度过低或是溶解了NO2导致装置①中溶液呈绿色,一是可设计将溶解的NO2赶走(a、c方案)再观察颜色变化。二是增加溶液中Cu(NO3)2溶液的浓度(d方案)观察反应后的颜色变化。
(6)要证明是Cu(NO3)2浓度过低或是溶解了NO2导致装置①中溶液呈绿色,一是可设计将溶解的NO2赶走(a、c方案)再观察颜色变化。二是增加溶液中Cu(NO3)2溶液的浓度(d方案)观察反应后的颜色变化。
9. (09全国卷Ⅰ29)(15分)已知周期表中,元素Q、R、W、Y与元素X相邻。Y的最高化合价氧化物的水化物是强酸。回答下列问题:
(1)W与Q可以形成一种高温结构陶瓷材料。W的氯化物分子呈正四面体结构,W的氧化物的晶体类型是 ;
(2)Q的具有相同化合价且可以相互转变的氧化物是 ;
(3)R和Y形成的二元化合物中,R呈现最高化合价的化合物的化学式是 ;
(4)这5个元素的氢化物分子中,①立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式) ,其原因是
;
②电子总数相同的氢化物的化学式和立体结构分别是
;
(5)W和Q所形成的结构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCL气体;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是
。
答案: (1)原子晶体。(2)NO2和N2O4(3)As2S5。(4)①NH3> AsH3 > PH3,因为前者中含有氢键,后两者构型相同,分子间作用力不同;②电子数相同的有SiH4、PH3和H2S结构分别为正四面体,三角锥和V形。(5)SiCl4 + 4NH3 = Si(NH2)4
+ 4HCl,3Si(NH2)4
= 8NH3 + Si3N4
(1)原子晶体。(2)NO2和N2O4(3)As2S5。(4)①NH3> AsH3 > PH3,因为前者中含有氢键,后两者构型相同,分子间作用力不同;②电子数相同的有SiH4、PH3和H2S结构分别为正四面体,三角锥和V形。(5)SiCl4 + 4NH3 = Si(NH2)4
+ 4HCl,3Si(NH2)4
= 8NH3 + Si3N4
 解析:本题可结合问题作答。W的氯化物为正四体型,则应为SiCl4或CCl4,又W与Q形成高温陶瓷,故可推断W为Si。(1)SiO2为原子晶体。(2)高温陶瓷可联想到Si3N4,Q为N,则有NO2与N2O4之间的相互转化关系。(3)Y的最高价氧化的的水化物为强酸,且与Si、N等相邻,则只能是S。R为As,所以R的最高价化合物应为As2S5。(4)显然x为P元素。①氢化物沸点顺序为NH3> AsH3
> PH3,因为前者中含有氢键后两者构型相同,分子间作用力不同。②SiH4、PH3和H2S的电子数均为18。,结构分别为正四面体,三角锥和V形。(5)由题中所给出的含字母的化学式可以写出具体的物质,然后配平即可。
解析:本题可结合问题作答。W的氯化物为正四体型,则应为SiCl4或CCl4,又W与Q形成高温陶瓷,故可推断W为Si。(1)SiO2为原子晶体。(2)高温陶瓷可联想到Si3N4,Q为N,则有NO2与N2O4之间的相互转化关系。(3)Y的最高价氧化的的水化物为强酸,且与Si、N等相邻,则只能是S。R为As,所以R的最高价化合物应为As2S5。(4)显然x为P元素。①氢化物沸点顺序为NH3> AsH3
> PH3,因为前者中含有氢键后两者构型相同,分子间作用力不同。②SiH4、PH3和H2S的电子数均为18。,结构分别为正四面体,三角锥和V形。(5)由题中所给出的含字母的化学式可以写出具体的物质,然后配平即可。
8.(09宁夏卷7) 将22.4L某气态氮氧化合物与足量的灼热铜粉完全反应后,气体体积11.2L(体积均在相同条件下测定),则该氮氧化合物的化学式为
A.NO2 B.N2O2 C.N2O D.N2O4
答案:A 解析:根据2NxOy+2yCu=2yCuO+xN2,以及题中数据反应后气体体积为反应前气体体积的一半,可以得到x=1,因此只有A选项符合题意。
解析:根据2NxOy+2yCu=2yCuO+xN2,以及题中数据反应后气体体积为反应前气体体积的一半,可以得到x=1,因此只有A选项符合题意。
7.(09上海卷 20)对于常温下pH为1的硝酸溶液,下列叙述正确的是
20)对于常温下pH为1的硝酸溶液,下列叙述正确的是
 A.该溶液lmL稀释至100mL后,pH等于3
A.该溶液lmL稀释至100mL后,pH等于3
 B.向该溶液中加入等体积、pH为13的氢氧化钡溶液恰好完全中和
B.向该溶液中加入等体积、pH为13的氢氧化钡溶液恰好完全中和
 C.该溶液中硝酸电离出的
C.该溶液中硝酸电离出的 与水电离出的
与水电离出的 之比值为
之比值为 。
。
 D.该溶液中水电离出的
D.该溶液中水电离出的 是pH为3的硝酸中水电离出的
是pH为3的硝酸中水电离出的 的100倍
的100倍
答案:AB
[解析]硝酸为强电解质,完全电离,稀释100倍,pH增大2,A项正确。硝酸电离出的c(H+)为0.1 mol/l,与水电离出的c(H+)为10-13 mol/l,二者之比应为1012,C项错。pH为3的硝酸中水电离出的c(H+)为10-11mol/l,故D项的比值应为1:100,D项错。
6.(09上海卷 7)在下列变化①大气固氮②硝酸银分解③实验室制取氨气中,按氮元素被氧化、被还原、既不被氧化又不被还原的顺序排列,正确的是
7)在下列变化①大气固氮②硝酸银分解③实验室制取氨气中,按氮元素被氧化、被还原、既不被氧化又不被还原的顺序排列,正确的是
 A.①②③ B.②①③ C.③②① D.③①②
A.①②③ B.②①③ C.③②① D.③①②
答案:A
[解析]大气固氮是指在放电条件下将游离态的氮气转化为一氧化氮的过程,氮元素被氧化。硝酸银分解过程中氮元素化合价降低,被还原。实验室制氨气的反应不属于氧化还原反应,故A项正确。
5.(09上海卷4)用浓氯化铵溶液处理过的舞台幕布不易着火。其原因是
①幕布的着火点升高 ②幕布的质量增加
③氯化铵分解吸收热量,降低了温度 ④氯化铵分解产生的气体隔绝了空气
A.①② B.③④ C.③④ D.②④
答案:B
[解析]氯化铵分解吸收热量,能降低火焰温度,并且分解产物氯化氢和氨气能隔绝空气,均破坏了可燃物的燃烧条件,故能使幕布不宜着火。
4.(09广东化学 15)取五等份NO2 ,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:
15)取五等份NO2 ,分别加入温度不同、容积相同的恒容密闭容器中,发生反应: 2NO2(g)
2NO2(g) N2O4(g),ΔH<0 反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是
N2O4(g),ΔH<0 反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是

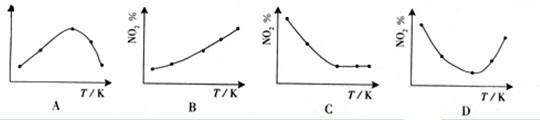
 答案:BD
答案:BD
 解析:
解析:
在恒容状态下,在五个相同的容器中同时通入等量的NO2,反应相同时间。那么则有两种可能,一是已达到平衡状态,二是还没有达到平衡状态,仍然在向正反应移动。若5个容器在反应相同时间下,均已达到平衡,因为该反应是放热反应,温度越高,平衡向逆反应方向移动,NO2的百分含量随温度升高而升高,所以B正确。若5个容器中有未达到平衡状态的,那么温度越高,反应速率越大,会出现温度高的NO2转化得快,导致NO2的百分含量少的情况,在D图中转折点为平衡状态,转折点左则为未平衡状态,右则为平衡状态,D正确。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com