
15.(2010·上海浦东区模拟)下列离子方程式书写正确的是( )。
A.NaHSO3溶液显弱酸性是因为:HSO3-+H2O SO32-+H3O+
SO32-+H3O+
B.尼泊金酸(HO- COOH)与碳酸氢钠溶液反应:
COOH)与碳酸氢钠溶液反应:
 HO-
HO- COOH +2HCO3-→-O-
COOH +2HCO3-→-O- COO-+2CO2↑+2H2O
COO-+2CO2↑+2H2O
C.电解氯化镁溶液时电极反应的离子方程式是:2Cl-+2H2O====Cl2↑+H2↑+2OH-
D.1L 2mol/L的FeBr2溶液中通入2.5mol Cl2:
2Fe2++8Br-+5Cl2====10Cl-+2Fe3++4Br2
[解析]选A。B项羧基酸性比碳酸强,酚羟基酸性比碳酸弱,故酚羟基不能发生反应;C项应该生成Mg(OH)2沉淀;D项Fe2+还原性比Br-强,正确的离子反应式为4Fe2++6Br-+5Cl2=10Cl-+4Fe3++3Br2。
14.(2010·淮安模拟)下列离子方程式书写不正确的是( )。
A.少量铁粉加入稀硝酸中:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
B.Ca(HCO3)2溶液与过量Ca(OH)2溶液反应:Ca2++HCO3-+OH-=CaCO3↓+H2O
C.NH4HCO3溶液和过量Ba(OH)2溶液共热:2HCO3-+2OH-+Ba2+=BaCO3↓+
CO32-+2H2O
D.Na2S溶液中通入足量H2S:S2-+H2S=2HS-
[解析]选AC。A项少量铁粉被稀硝酸氧化成Fe3+;C项反应的离子方程式为
NH4++HCO3-+2OH-+Ba2+=BaCO3↓+2H2O+NH3↑。
13.(2010·九江模拟)下列反应的离子方程式正确的是( )。
A.氯化铝溶液中加入过量氨水:Al3++4NH3•H2O AlO2-+4NH4++2H2O
AlO2-+4NH4++2H2O
B.用小苏打治疗胃酸过多:HCO3-+H+ CO2↑+H2O
CO2↑+H2O
C.把过量的NaHCO3溶液与Ca(OH)2溶液混合:HCO3-+Ca2++OH- CaCO3↓+H2O
CaCO3↓+H2O
D.如将少量SO2通入漂白粉溶液中:H2O+SO2+Ca2++2ClO- CaSO3↓+2HClO
CaSO3↓+2HClO
[解析]选B。分析选项A时,应该注意到Al(OH)3不能溶于过量氨水,故此选项不正确;C项错在未考虑反应物中量的关系。应为:2HCO3-+Ca2++2OH- CaCO3↓+2H2O+CO32-;D项错在忽略了HClO可以将+4价的硫氧化,应为:H2O+SO2+Ca2++ClO-
CaCO3↓+2H2O+CO32-;D项错在忽略了HClO可以将+4价的硫氧化,应为:H2O+SO2+Ca2++ClO- CaSO4↓+2H++Cl-;只有B项正确。
CaSO4↓+2H++Cl-;只有B项正确。
12.(2010·邯郸模拟)下列反应的离子方程式书写正确的是( )。
A.氯化铝溶液中加入过量氨水:Al3++4NH3·H2O AlO2-+4NH4++2H2O
AlO2-+4NH4++2H2O
B.澄清石灰水与过量苏打溶液混合:Ca2++OH-+HCO3- CaCO3↓+H2O
CaCO3↓+H2O
C.碳酸钙溶于醋酸:CaCO3+2H+ Ca2++CO2↑+H2O
Ca2++CO2↑+H2O
D.氯化亚铁溶液中通入氯气:2Fe2++Cl2 2Fe3++2Cl-
2Fe3++2Cl-
[解析]选D。A项为Al3++3NH3·H2O Al(OH)3↓+3NH4+ ;B项为Ca2++2OH-+
Al(OH)3↓+3NH4+ ;B项为Ca2++2OH-+
2HCO3- CaCO3↓+2H2O+CO32- ; C项醋酸为弱酸,应写化学式。
CaCO3↓+2H2O+CO32- ; C项醋酸为弱酸,应写化学式。
11.(2010·合肥模拟)已知某溶液中含有碳酸钠、硫酸钠、氢氧化钠、氯化钠四种溶质,欲将该溶液中四种溶质的阴离子逐一检验出来,所加试剂先后顺序合理的是( )。
A.HNO3、Ba(NO3)2、NH4NO3、AgNO3
B.HNO3、NH4NO3、Ba(NO3)2、AgNO3
C.NH4NO3、HNO3、Ba(NO3)2、AgNO3
D.NH4NO3、HNO3、AgNO3、Ba(NO3)2
[解析]选C。检验Cl-可以用AgNO3溶液,检验SO42-可以用Ba(NO3)2溶液,检验OH-可以用NH4NO3溶液,检验CO32-可以用HNO3溶液。若先加AgNO3溶液,则能够产生AgCl、Ag2SO4、Ag2CO3和AgOH(或Ag2O)四种沉淀;若先加Ba(NO3)2溶液,则能产生BaSO4和BaCO3两种白色沉淀;若先加稀硝酸,则除了将CO32-检验出外,还将OH-消耗掉,所以应该先加NH4NO3溶液,再加稀硝酸,然后加Ba(NO3)2溶液,最后加AgNO3溶液。
10.(2010·三亚模拟)下列离子方程式书写正确的是( )。
A.硫酸除铜绿:4H++Cu2(OH)2CO3 2Cu2++CO2↑+3H2O
2Cu2++CO2↑+3H2O
B.盐酸除铁锈:2H++FeO Fe2++H2O
Fe2++H2O
C.醋酸除水垢:2CH3COO-+2H++CaCO3 (CH3COO)2Ca+CO2↑+H2O
(CH3COO)2Ca+CO2↑+H2O
D.稀硝酸除银镜:Ag+2H++NO3- Ag++NO2↑+H2O
Ag++NO2↑+H2O
[解析]选A。铁锈的主要成分是Fe2O3,B选项错误;醋酸是弱电解质,不能拆成离子形式,C选项错误;银和稀硝酸反应生成NO,D选项错误。
9.(2010·威海模拟)有一无色溶液,可能含有K+、Al3+、Mg2+、NH4+、Cl-、SO42-、
HCO3-、MnO4-中的一种或几种。为确定其成分,做如下实验:①取部分溶液,加入适量的Na2O2固体,产生无色无味的气体并产生白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生。下列推断正确的是( )。
A.肯定有K+、HCO3-、MnO4-
B.肯定有Al3+、Mg2+、HCO3-
C.肯定有Al3+、Mg2+、SO42-
D.肯定有Al3+、Mg2+、NH4+、Cl-
[解析]选C。首先由“无色”溶液,否定MnO4-的存在;再由“加入适量Na2O2固体,产生无色无味的气体并生成白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解”,可判断原溶液含Mg2+、Al3+,因为Al(OH)3溶于过量碱而Mg(OH)2不溶;又根据“加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生”,可判断该沉淀是BaSO4,原溶液中含SO42-,综合分析结果可知,溶液中肯定有Mg2+、Al3+、SO42-,故选C。
8.(2010·涪陵模拟)某溶液中含有Ba2+、Cu2+、Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离,其流程如下图所示。下列说法正确的是( )。
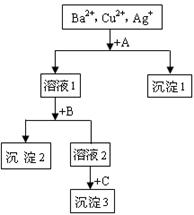
A.试剂A为Na2SO4溶液
B.沉淀3的化学式可能是BaSO4
C.生成沉淀1的离子方程式为:Cu2++2OH-=Cu(OH)2↓
D.生成沉淀2的离子方程式为:Ag++Cl-=AgCl↓
[解析]选B。含有Ba2+、Cu2+、Ag+的溶液中,若先加NaOH溶液,则会产生Cu(OH)2和AgOH(或Ag2O)两种沉淀;若先加Na2SO4溶液,则会产生BaSO4和Ag2SO4两种沉淀;若先加盐酸,则只会产生AgCl一种白色沉淀,所以试剂A为盐酸溶液,所得溶液1中含有Ba2+和Cu2+;若向溶液1中先加NaOH溶液,则只会产生Cu(OH)2沉淀,若先加Na2SO4溶液,则会产生BaSO4一种沉淀,所以NaOH溶液和Na2SO4溶液加入的先后顺序,对“离子逐一沉淀分离”的要求无影响,即B为NaOH溶液或Na2SO4溶液,沉淀2为Cu(OH)2或BaSO4沉淀,C为Na2SO4溶液或NaOH溶液,沉淀3为BaSO4或
Cu(OH)2沉淀。
7.(2010·宝鸡模拟)已知NH4++AlO2-+2H2O Al(OH)3↓+NH3·H2O,向含有等物质的量的NH4+、Al3+、H+混合溶液中,慢慢滴加NaOH溶液,直至过量,并不断搅拌,依次发生了数个离子反应,则第三个离子反应是( )。
Al(OH)3↓+NH3·H2O,向含有等物质的量的NH4+、Al3+、H+混合溶液中,慢慢滴加NaOH溶液,直至过量,并不断搅拌,依次发生了数个离子反应,则第三个离子反应是( )。
A.H++OH- H2O
H2O
B.Al3++3OH- Al(OH)3↓
Al(OH)3↓
C.Al(OH)3+OH- AlO2-+2H2O
AlO2-+2H2O
D.NH4++OH- NH3·H2O
NH3·H2O
[解析]选D。通常来说溶液中的离子反应以H+与OH-间的中和反应速率最快,其它则需根据某些原理分析。故第一个反应为中和反应:H++OH- H2O,第二个反应为:Al3++3OH-
H2O,第二个反应为:Al3++3OH- Al(OH)3↓,但发生第二个反应后,又出现两性Al(OH)3与NH4+何者优先反应的问题。若Al(OH)3优先与OH-反应,则产物AlO2-能够与NH4+又发生题给的双水解反应而不能共存又变回Al(OH)3,故第三个反应为NH4++OH-
Al(OH)3↓,但发生第二个反应后,又出现两性Al(OH)3与NH4+何者优先反应的问题。若Al(OH)3优先与OH-反应,则产物AlO2-能够与NH4+又发生题给的双水解反应而不能共存又变回Al(OH)3,故第三个反应为NH4++OH- NH3·H2O。最后一个离子反应为Al(OH)3+OH-
NH3·H2O。最后一个离子反应为Al(OH)3+OH- AlO2-+2H2O。
AlO2-+2H2O。
6.(2010·常熟模拟)某混合溶液中所含离子的浓度如下表,则M离子可能为( )。
|
所含离子 |
NO3- |
SO42- |
H+ |
M |
|
浓度/(mol·L-1) |
2 |
1 |
2 |
1 |
A.Cl- B.Ba2+ C.F- D.Mg2+
[解析]选D。阴离子所带的负电荷的浓度为:1×2mol·L-1+2×1mol·L-1=4mol·L-1,阳离子所带的正电荷浓度为:1×2mol·L-1,根据电荷守恒M应带两个单位正电荷,而Ba2+与SO42-不共存,所以M为Mg2+。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com