
1. 归纳法:由一些特殊事例推出一般结论的推理方法.
特点:由特殊→一般
问题1:这里有一袋球共十二个,我们要判断这一袋球是白球,还是黑球,请问怎么办?
方法一:把它倒出来看一看就可以了.
特点:方法是正确的,但操作上缺乏顺序性.
方法二:一个一个拿,拿一个看一个.
比如结果为:第一个白球,第二个白球,第三个白球,……,第十二个白球,由此得到:这一袋球都是白球.
特点:有顺序,有过程.
问题2:在数列 中,
中, ,先算出a2,a3,a4
,先算出a2,a3,a4 的值,再推测通项an的公式.
的值,再推测通项an的公式.
过程: ,
, ,
, ,由此得到:
,由此得到: ,
,
解决以上两个问题用的都是归纳法.
再请看数学史上的两个资料:
资料1: 费马(Fermat)是17世纪法国著名的数学家,他是解析几何的发明者之一,是对微积分的创立作出贡献最多的人之一,是概率论的创始者之一,他对数论也有许多贡献.但是,费马曾认为,当n∈N时, 一定都是质数,这是他对n=0,1,2,3,4时的值分别为3,5,17,257,65537作了验证后得到的.
一定都是质数,这是他对n=0,1,2,3,4时的值分别为3,5,17,257,65537作了验证后得到的.
18世纪伟大的瑞士科学家欧拉(Euler)却证明了当n=5时,
 =4 294 967 297=6
700 417×641,从而否定了费马的推测.
=4 294 967 297=6
700 417×641,从而否定了费马的推测.
有人说,费马为什么不再多算一个数呢?今天我们是无法回答的.但是要告诉同学们,失误的关键不在于多算一个上!
资料2:f(n)=n2+n+41,当n∈N时,f(n)是否都为质数?
f(0)=41,f(1)=43,f(2)=47,f(3)=53,f(4)=61,
f(5)=71,f(6)=83,f(7)=97,f(8)=113,f(9)=131,
f(10)=151,… f(39)=1 601.
但是f(40)=1 681=412是合数
算了39个数不算少了吧,但还不行!我们介绍以上两个资料,不是说世界级大师还出错,我们有错就可以原谅,也不是说归纳法不行,不去学了,而是要找出运用归纳法出错的原因,并研究出对策来.
对于生活、生产中的实际问题,得出的结论的正确性,应接受实践的检验,因为实践是检验真理的唯一标准.对于数学问题,应寻求数学证明

课件展示:多媒体课件(游戏:多米诺骨牌) ,多米诺骨牌游戏要取得成功,必须靠两条:
(1)骨牌的排列,保证前一张牌倒则后一张牌也必定倒;
(2)第一张牌被推倒.
用这种思想设计出来的,用于证明不完全归纳法推测所得命题的正确性的证明方法就是数学归纳法.
23.(2010·宜宾模拟)某强酸性溶液X,含有Ba2+、Al3+、SiO32-、NH4+、Fe2+、Fe3+、
CO32-、SO42-、NO3-中的一种或几种离子,取溶液进行连续实验,能实现如下转化:
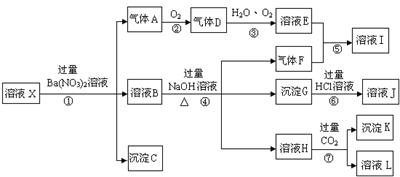
依据以上信息,回答下列问题:
(1)上述离子中,溶液X中肯定含有的是:_____________________________;不能肯定的是:_________________。对不能确定是否存在的离子,可以另取X溶液于一支试管中,选择下列试剂中的一种加入X溶液中,根据现象就可判断,则该试剂是:___________。(选填:①NaOH溶液,②酚酞试剂,③石蕊试剂,④pH试纸,⑤KSCN溶液,⑥KMnO4溶液)
(2)气体F的化学式为:_______________,沉淀G的化学式为:_____________,沉淀K的化学式为:____________,实验中,可以观察到反应②的现象是:________________。
(3)写出步骤①所有发生反应的离子方程式_________________、__________________。
(4)要使步骤③中,D、H2O、O2三种物质恰好发生化合反应,则D、H2O、O2物质的量之比是:______________________。
[解析]强酸性溶液中含有H+,则不含SiO32-、CO32-;加入Ba(NO3)2溶液后生成的沉淀一定是BaSO4,则溶液中含有SO42-,不含Ba2+;气体A能够和氧气反应,所以A为NO,D为NO2,D到E的反应为:4NO2+O2+2H2O 4HNO3,说明该溶液中含有还原性离子,即Fe2+,则原溶液中一定没有NO3-。溶液B能够和NaOH溶液反应生成气体,则该气体一定是NH3,原溶液中一定含有NH4+。符合转化关系:“B
4HNO3,说明该溶液中含有还原性离子,即Fe2+,则原溶液中一定没有NO3-。溶液B能够和NaOH溶液反应生成气体,则该气体一定是NH3,原溶液中一定含有NH4+。符合转化关系:“B H
H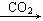 沉淀K”的K为Al(OH)3,则溶液中含有Al3+。
沉淀K”的K为Al(OH)3,则溶液中含有Al3+。
[答案](1)SO42-、Al3+、Fe2+、NH4+ Fe3+ ⑤
(2)NH3 Fe(OH)3 Al(OH)3 气体由无色变成红棕色
(3)Ba2++SO42-=BaSO4↓ 3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
(4)4∶2∶1
()
22.(2010·锦州模拟)已知A和B两支试管的溶液中共含有K+、Ag+、Mg2+、Cl-、OH-、NO3-六种离子,向试管A的溶液中滴入酚酞试液呈粉红色。请回答下列问题:
(1)试管A的溶液中所含上述离子共有______种。
(2)若向某试管中滴入稀盐酸产生沉淀,则该试管为______(填“A”或“B”)。
(3)若向试管B的溶液中加入合适的药品,过滤后可以得到相应的金属和仅含一种溶质的溶液,则加入的药品是___________(填化学式)。
(4)若将试管A和试管B中的溶液按一定体积比混合过滤后,蒸干滤液可得到一种纯净物,则混合过程中发生反应的离子方程式为_______________、________________。
(5)若试管A和试管B中共有四种物质按等物质的量溶解于试管中,再将A和B中的溶液混合过滤,所得滤液中各种离子的物质的量之比为________________。
(6)若向由试管A的溶液中阳离子组成的碳酸氢盐溶液中,滴入少量Ba(OH)2溶液,则发生反应的离子方程式为______________________________。
[解析]酚酞试液呈粉红色,说明试管A溶液中含有OH-,则没有能够和OH-结合成沉淀的离子,所以Ag+、Mg2+不存在,它们一定在试管B中,根据电荷守恒,则必定存在K+;Cl-能够和Ag+结合成AgCl沉淀,在B中不含Cl-,根据电荷守恒,B中所含的阴离子一定是NO3-。综上所述,A中含有K+、Cl-和OH-三种离子,B中含有Ag+、Mg2+和NO3-三种离子。然后结合题目要求即得答案。
[答案](1)3 (2)B (3)Mg
(4)Ag+ +Cl-=AgCl↓、Mg2++2OH-=Mg(OH)2↓
(5)n (K+)︰n (Mg2+)︰n (NO3-)=4︰1︰6
(6)Ba2++2OH-+2HCO3-=BaCO3↓+CO32-+2H2O
21.(2010·沈阳模拟)某强碱性溶液中可能含有的离子是K+、NH4+、Al3+、AlO2-、
SO42-、SiO32-、CO32-、Cl-中的某几种离子,现进行如下实验:
①取少量的溶液用硝酸酸化后,加Ba(NO3)2溶液,无沉淀生成。
②另取少量溶液逐滴加入盐酸,其现象是:一段时间保持原样后,开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失。
(1)原溶液中肯定存在的离子是____________________________________,肯定不存在的离子是___________________________。
(2)已知一定量的原溶液中加入5mL 0.2mol/L盐酸时,沉淀会完全消失,加入足量的硝酸银溶液可得到沉淀0.187g,则原溶液中是否含有Cl-?_________________。
(3)按照反应顺序逐步书写出②中发生反应的离子反应方程式
①H++OH-=H2O ②__________________
③__________________ ④HCO3-+H+=H2O+CO2↑
⑤__________________
[解析]强碱性溶液中一定不含Al3+、NH4+。取少量的溶液用硝酸酸化后,加Ba(NO3)2溶液,无沉淀生成,说明溶液中肯定不存在SO42-、SiO32-;根据实验②可以判断溶液中一定有AlO2-和CO32-,发生的反应依次为H++OH-=H2O、AlO2-+H++H2O=Al(OH)3↓、CO32-+H+=HCO3-、HCO3-+H+=H2O+CO2↑、Al(OH)3+3H+=Al3++3H2O;所以溶液中一定存在OH-、AlO2-、CO32-和K+,一定不存在Al3+、NH4+、SO42-、
SiO32-。若原溶液中没有Cl-,加入足量的硝酸银溶液可得到沉淀的质量为0.005L×0.2mol/×143.5g /mol=0.1435g<0.187g,所以原溶液中含有Cl-。
[答案](1)OH-、AlO2-、CO32-、K+ Al3+、NH4+、SO42-、SiO32-
(2)含有Cl-
(3)②AlO2-+H++H2O=Al(OH)3↓ ③CO32-+H+=HCO3-
⑤Al(OH)3+3H+=Al3++3H2O
20.(2010·保定模拟)某溶液中大量存在五种离子:NO3-、SO42-、Fe3+、H+、X,其物质的量之比为:n(NO3-)∶n(SO42-)∶n(Fe3+)∶n(H+)∶n(X)=2∶3∶1∶3∶1,则X可能为( )。
A.Fe2+ B.Mg2+ C.Cl- D.Ba2+
[解析]选B。SO42-和Ba2+能够反应生成BaSO4沉淀,在酸性条件下NO3-能够将Fe2+氧化成Fe3+,所以溶液中一定没有Ba2+和Fe2+。假设题中所给的离子的物质的量依次为2mol、3mol、1mol、3mol和1mol,阳离子所带的正电荷数为:n(正电荷)=3n(Fe3+)+n(H+)=3×1mol+1×3mol=6mol,阴离子所带的负电荷数为:n(负电荷)=n(NO3-)+
2n(SO42-)=1×2mol+2×3mol=8mol,所以还缺少2mol正电荷,因为n(X)=1mol,所以X带两个正电荷,为Mg2+。
19.(2010·潍坊模拟)某一无色溶液,若向其中加入足量饱和氯水,溶液呈橙黄色;再向橙黄色溶液中滴加BaCl2溶液,产生白色沉淀;若向原溶液中加入铝粉,有气体放出。该溶液可能大量存在的一组离子是( )。
A.K+、H+、NO3-、Na+ B.H+、Br-、SO42-、Na+
C.SO42-、Br-、OH-、Fe3+ D.H+、Br-、SO32-、K+
[解析]选B。A项中加入BaCl2不产生沉淀;C项中因Fe3+呈棕黄色,溶液不是无色的;D项中H+和SO32-不能大量共存,故选B。
18.(2010·威海模拟)有一无色溶液,可能含有K+、Al3+、Mg2+、NH4+、Cl-、SO42-、
HCO3-、MnO4-中的一种或几种。为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体并产生白色沉淀再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生。下列推断正确的是( )。
A.肯定有K+、HCO3-、MnO4-
B.肯定有Al3+、Mg2+、HCO3-
C.肯定有Al3+、Mg2+、SO42-
D.肯定有Al3+、Mg2+、NH4+、Cl-
[解析]选C。首先由“无色”溶液,否定MnO4-的存在;再由“加入适量Na2O2固体,产生无色无味的气体并生成白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解”,可判断原溶液含Mg2+、Al3+,因为Al(OH)3溶于过量碱而Mg(OH)2不溶;又根据“加入酸化的Ba(NO3)2溶液,有白色沉淀产生”,可判断该沉淀是BaSO4,原溶液中含
SO42-,综合分析结果可知,溶液中肯定有Mg2+、Al3+、SO42-,故选C。
17.(2010·南京模拟)某无色溶液与NH4HCO3作用能产生气体,此溶液中可能大量共存的离子组是( )。
A.Cl-、Mg2+、H+、Zn2+、SO42- B.Na+、Ba2+、NO3-、OH-、SO42-
C.K+、NO3-、SO42-、OH-、Na+ D.MnO4-、K+、Cl-、H+、SO42-
[解析]选AC。A项中的离子能共存,且H+能与HCO3-反应生成气体;B中的Ba2+与SO42-不能共存;C项中离子间能共存且OH-能与NH4+反应生成气体;D中的
MnO4-是一种紫色的离子,不合题意,所以正确答案为AC。
16.(2010·镇江模拟)在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的有( )。
A.滴加石蕊试液显红色的溶液:Fe3+、NH4+、Cl-、SCN-
B.pH为1的溶液:Cu2+、Na+、Al3+、NO3-
C.水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+
D.所含溶质为Na2SO4的溶液:K+、CO32-、NO3-、Mg2+
[解析]选B。A中Fe3+与SCN-不共存;C中“水电离出来的c(H+)=10-13mol/L的溶液可能为酸,可能为碱,而无论在酸中还是碱中HCO3-都不可共存,D中Mg2+与CO32-不共存。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com