
2、如图1-1所示,物体A静置于水平桌面上,下列关于物体所受作用力的说法中正确的是:( )
A. 桌面受到的压力就是物体的重力
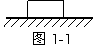 B. 桌面受到的压力是由于它本身发生了微小形变而产生的 A
B. 桌面受到的压力是由于它本身发生了微小形变而产生的 A
C. 桌面由于发生了微小形变而对物体产生了垂直于桌面的支持力
D. 物体由于发生了微小形变而对桌子产生了垂直于桌面的压力
1、关于力的下列说法中正确的是…………………………………………( )
A、力可以脱离物体而独立存在
B、只要有物体存在就一定有力存在
C、物体运动状态发生改变,则该物体一定受力作用
D、物体的形状改变,物体不一定受力
2.环境保护
随着人类生产和社会活动的增加,大量污染物进入环境,冲击生态环境和影响人体健康,人们对改善环境质量要求可持续发展的愿望日益迫切。从二十世纪八十年代开始,酸雨、臭氧空洞和全球气候变暖这三大全球环境问题,已经成为上至政府下至黎民百姓议论的话题,如何解决此问题已经不是一代人能解决的问题,是二十一世纪的热点问题。联合国于1972年首次召开世界环境会议,会议通过了将每年的6月5日定为“世界环境日”的决议。每年的环境日都有一个主题,旨在通过宣传,强化公众环境意识。
环境问题不仅与化学联系在一起,而且还广泛涉及到物理、生物等多学科知识。与本章内容密切相关的环保问题有:
①氟利昂造成臭氧空洞,使紫外线辐射增强,导致皮肤癌等多种疾病。
②微量的硒是正常的肝功能必须酶的关键组成元素,但稍加大量的硒对人体有毒。
③二氧化硫及形成酸雨的危害。
④接触法制硫酸的反应原理、设备与保护环境的重要性相联系,与化工生产的原理相联系。
⑤“三废”的污染与生物中环境保护知识有关,如大气监测、水质监测、生化需氧量计算等。
⑥垃圾发电消除污染与物理知识中能量转换有关。
⑦空气质量预报,污染指数有关分析。
二氧化硫是污染大气的主要有害物质之一。少量的二氧化硫能刺激人的眼睛,损伤呼吸器官,浓度高达一定程度时,会使人死亡;二氧化硫可加速钢铁的腐蚀;以及由其生成的三氧化硫进入植物叶子的气孔就产生硫酸,细胞组织被水解和脱水引起黄萎和落叶;硫的氧化物所形成的酸雨,能毒害鱼类和其他水生生物,使土壤酸化、破坏生态环境、危害建筑和人类健康等。防止酸雨的主要措施有:①提高能源的利用率,减少污染气体的排放;②改变能源结构,发展无污染能源;③增强防“酸”意识;④回收处理二氧化硫废气。
[例题]最近,国际上提出的“绿色化学”是指化学工业生产中的
A.对废水、废气、废渣进行严格处理
B.对化学生产中不排放任何有害物质
C.对化工厂及周围种草、种树、种花,使工厂成为花园式工厂
D.以绿色植物为原料,以生物催化剂实现化工生产过程的化学
解析:绿色化学是指以绿色意识为指导,研究和设计没有(或尽可能少的)环境负作用,在技术上和经济上可行的化学品与化学过程。其目标就是研究与寻找能充分利用无毒害原材料,最大限度地节约能源,在各个环节都实现净化和无污染的反应途径的工艺,是始端实现污染预防而非终端治理的科学手段。由于它在通过化学转化获取新物质的过程中,就已充分利用了每种原料的全部原子,因而生产过程和末端均为零排放或零污染,是提高经济效益和环境效益的根本措施。
绿色化学的研究重点有四个:一是设计对人类健康和环境危害小的,淘汰有毒的反应起始物(原材料);二是选择最佳的反应(生产)条件,以实现最大限度的节能和零排放;三是研究最佳的转换反应和良性的试剂(含催化剂);四是设计对人类健康和环境更安全的目标化合物(最终产品)。
答案:B
氧族元素是重要的非金属元素族,而且硫及其化合物硫酸在国民经济建设中有着重要的作用,例如在印染、制药、有机等工业方面是重要的原料。因此本章内容是近几年来高考命题的热点。
1.硫及其化合物的性质和相互转化关系
高考在本部分考查的知识点较多,归纳起来主要集中在如下几个方面:
①硫及其化合物的相互转化关系。
②SO2、H2S、SO 的还原性。
的还原性。
③浓H2SO4的性质及其应用,硫酸盐的组成。
④以本部分知识为载体的化学计算和化学实验。
以上几个考试热点分散在具体题目中一般具有以下几个命题特点:
①单纯测试元素及化合物的知识,主要以选择题为主,难度不大,目的是起到稳定考生情绪,减少考生焦虑的作用。
②由于硫是一种重要的非金属,硫及其化合物间的转化关系复杂,与其他各族元素以及氧化还原反应等理论知识联系密切,利用这一点编制一些综合性较强的推断题、计算题和实验题。
3.硫酸工业
(1)硫酸的工业制法(接触法)
系统地学习掌握某一物质的工业制法,一般要从所用原料、化学反应、适宜条件、生产过程、主要设备、环境保护等角度去分析理解。按照上述要求,工业上接触法制硫酸概括为“五个三”,即三种原料、三个反应、适宜生产条件中的三个问题、三个生产过程、三个主要设备等:
二氧化硫的制取和净化
4FeS2+11O2 2Fe2O3+8SO2 (沸腾炉)
2Fe2O3+8SO2 (沸腾炉)
二氧化硫氧化成三氧化硫
2SO2+O2 2SO3 (接触室)
2SO3 (接触室)
三氧化硫的吸收和硫酸的生成 SO3+H2O===H2SO4 (吸收塔)
(2)关于硫酸工业综合经济效益的讨论
①环境保护与原料的综合利用。化工生产必须保护环境,严格治理“三废”,并尽可能把“三废”变为有用的副产品,实现原料的综合利用。硫酸厂的“三废”经处理后,不仅消除了污染,而且也使SO2和黄铁矿矿渣得到合理利用。
②能量的充分利用。许多化学反应是放热反应。化工生产中应充分利用反应热,这对于降低成本具有重要意义。硫酸生产中的反应热得到充分利用后,不仅不需要由外界向硫酸厂供应能量,而且还可以由硫酸厂向外界输出大量能量。
③生产规模和厂址选择。现代化工生产要求有较大的生产规模;厂址选择涉及原料、水源、能源、土地供应、市场需求、交通运输、环境保护等因素,应对这些因素综合考虑,作出合理的抉择。由于硫酸是腐蚀性液体,不便贮存和运输,因此要求把硫酸厂建在靠近硫酸消费中心的地区,厂址应避开人口稠密的居民区和环境保护要求高的地区。工厂规模的大小,主要由硫酸用量的多少来决定。
(3)环境保护
环境污染主要包括大气污染、水污染、土壤污染、食品污染,此外还包括固体废弃物、放射性、噪声等污染。大气污染物是指粉尘、煤烟、硫的氧化物、氮的化合物、碳氢化合物等,其中二氧化硫是污染大气的主要有害物质之一,易形成酸雨,对人体、生物、物品有严重的危害性;其来源除硫酸厂的尾气中含有二氧化硫外,大量的二氧化硫来源于煤和石油的燃烧、金属矿石的冶炼。消除大气污染的主要方法之一是减少污染物的排放。
2.氧族元素
(1)氧族元素的相似性
①最外层都有6个电子,负化合价都为-2价,除氧外,最高正价为+6价。(除H2O2、OF2及FeS2外)
②气态氢化物通式为H2R,除H2O,对热稳定性都较差,如H2S 300℃以上即分解,H2Te 0℃即分解。除氧外,都有氧化物(RO2、RO3),对应的水化物都是含氧酸。
(2)氧族元素的递变性
①熔沸点:O2→Te逐渐升高
②氧化性:O2>S>Se>Te
③氢化物稳定性:H2O>H2S>H2Se>H2Te
④含氧酸酸性:H2SeO4>H2SO4(特殊)
(3)氧和硫的对比
①Na2S与Na2O都呈碱性,CS2与CO2一样呈酸性。碱性氧化物与酸性氧化物可反应生成盐,碱性硫化物与酸性硫化物亦可反应生成盐。如:Na2S+CS2===Na2CS3
②含氧酸盐中的氧可部分或全部被硫取代,如Na2S2O3可看作硫取代Na2SO4中的部分氧。
③在FeS2中S为-1价,在Na2O2、H2O2中O为-1价。
1.硫及其化合物间的转化关系
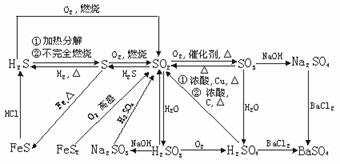
(1)硫和硫的化合物及不同价态的含硫物质是通过氧化还原规律联系在一起的。
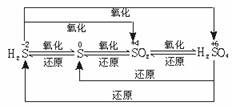
低价态的硫元素通过氧化剂的氧化反应,可以变为较高价态的硫元素,高价态的硫元素通过还原反应,可以转变为较低价态的硫元素。要能熟练写出H2S、S、SO2、H2SO4等含硫物质相互转化的化学方程式。
(2)相同价态的含硫化合物间,是通过酸碱反应规律联系在一起的:
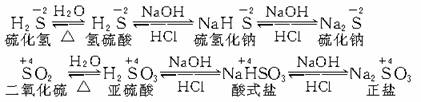
把上述含硫物质的氧化还原反应规律和酸碱反应规律结合在一起,便可从纵、横两个方面提示出硫及其化合物中的相互联系,形成科学的知识网络。
30.答案:(1)A:NH4HSO3或(NH4)2SO3 B:NH4HSO4或(NH4)2SO4 C:SO2 D:NH3 E:K2SO3 F:K2SO4
(2)SO +Br2+H2O===SO
+Br2+H2O===SO +2Br-+2H+
+2Br-+2H+
(3)通过焰色反应鉴定K+(隔钴玻璃火焰呈浅紫色);取少量F的溶液加入氯化钡和盐酸的溶液,若产生白色沉淀,证明SO 的存在
的存在
解析:这个图示看起来复杂,实际上若能迅速找到突破点,问题并不难解。
A溶液既能与浓硫酸反应,又能与氢氧化钾反应,说明它的阴离子和阳离子为含有弱电解质的离子或能被氧化的离子。反应中都有气体产生,说明阴、阳离子都具挥发性。无色气体C与氨水反应,D又与C的溶液反应,可见D为NH3,C为CO 、HCO
、HCO 或SO
或SO 、HSO
、HSO 等。E与溴水反应,所以排除CO
等。E与溴水反应,所以排除CO ,E是K2SO3,F即为K2SO4。这样其他问题均可得出答案。
,E是K2SO3,F即为K2SO4。这样其他问题均可得出答案。
●命题趋向与应试策略
29.答案:(1)AB
(2)非金属 只有非金属元素才既能呈正价又能呈负价
(3)S H2S
解析:本题的设置意在考查考生对非金属元素的单质及化合物性质的综合认识水平,与之相结合,还考查了考生的分析、推理、正向思维与逆向思维、抽象思维和发散思维的能力。解本题的关键在于进行逻辑推理。
化合物A既然是由甲、乙两种单质化合而成的,则化合物A中一定含有乙元素。再看框图的左边纵行,单质甲不含乙元素,而A中含乙元素,则A中的乙元素必来自于B中。至于C是否含有乙元素从题给条件上无法判断,这样一定含乙元素的应是A、B两种化合物。由框图的右侧纵行可以看出,由于反应物A、B都含乙元素,而其产物为单质乙,则A、B中的乙元素必有一种呈正价,另一种呈负价,只有非金属才有这种性质。所以乙为非金属。对第(3)问,要求对元素化合物知识十分熟悉,而且习惯于发散思维。本题应从两种含有相同元素的化合物反应生成该元素的单质作为思维的出发点。再思考能在二元化合物中呈正、负两种价态的非金属最常见的就是硫,2H2S+SO2===3S↓+2H2O。将这几种物质放到所给出的反应关系中去试验,就可得出结论:乙为S,B为H2S。
本题在整体设计上由易到难,考查的层次逐步深入。将化合价的基本概念与具体反应相结合,考查了逻辑思维和发散思维的能力,表明了高考的方向。
28.答案:(1)M(Na2SO4)=0.40 mol·L-1 M(Na2CO3)=1.00 mol·L-1
(2)1.12 L
解析:(1)14.51 g白色沉淀是BaCO3和BaSO4的混合物。
M(Na2SO4)= =0.40 mol·L-1
=0.40 mol·L-1
M(Na2CO3)= =1.00 mol·L-1
=1.00 mol·L-1
(2)设生成的气体在标准状况下的体积为x,
BaCO3+2HNO3===Ba(NO3)2+H2O+CO2↑
1 mol 22.4 L
 mol
x
mol
x
x= =1.12 L。
=1.12 L。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com