
1、盐溶液 + 金属 → 新盐+ 新金属
3、几种盐在水中的解离方程式:
NaCl = Na+ + Cl- Al2(SO4)3 = 2Al3+ + 3 SO42-
KNO3 =K+ + NO3- KMnO4 = K+ + MnO4 -
CuSO4 =Cu2+ + SO42- BaCl2 = Ba2+ + 2Cl -
酸碱盐概念的比较
|
|
化学组成 |
举例 |
溶液中的阴、阳离子 |
|
酸 |
氢离子和酸根离子 |
HNO3 |
阳离子:全部是H+,阴离子是酸根离子 |
|
碱 |
氢氧根离子和金属离子 |
KOH |
阴离子:金属离子, 阴离子:全部是OH-- |
|
盐 |
金属离子和酸根离子 |
AgNO3 |
阳离子:金属离子 阴离子:酸根离子 |
附表1 稀硫酸的化学性质(稀盐酸相似)
|
实验内容 |
实验现象 |
实验结论(或化学方程式,注明基本类型) |
|
跟指示剂反应 1、 紫色石蕊试液 2、 无色酚酞试液 |
1、 试液显( 红 )色 试液显( 无 )色 |
1、 紫色石蕊遇酸溶液(变红 ) 2、 无色酚酞遇酸溶液( 不变色 ) |
|
跟金属反应 1、镁条 2、锌粒 3、铁钉 |
1、反应剧烈,产生(大量无色气泡),镁条溶解; 2、反应较剧烈,产生(无色气泡 ),锌粒逐渐溶解; 3、铁钉表面有少量(无色气泡 ),溶液逐渐变为(浅绿)色 |
Mg+H2SO4=MgSO4+H2↑ Zn+H2SO4=ZnSO4+H2↑ Fe+H2SO4=FeSO4+H2↑ |
|
跟金属氧化物反应 1、铁锈(除铁锈) 2、氧化铜 |
1、 铁钉表面的锈逐渐溶解,溶液显(黄 )色 2、 黑色固体溶解,溶液显( 蓝 )色 |
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O CuO+H2SO4=CuSO4+H2O |
|
跟碱反应 Cu(OH)2 |
蓝色固体慢慢溶解,溶液显(蓝 )色 |
Cu(OH)2+H2SO4=CuSO4+2H2O |
|
跟盐反应 1、BaCl2溶液 2、Na2CO3固体 |
1、生成(白色沉淀 ) 2、固体溶解,产生大量(无色气泡 ) |
1、 BaCl2+H2SO4=BaSO4↓ +2HCl 2、 Na2CO3+H2SO4= Na2 SO4+ H2O+ CO2↑ |
附表2盐酸与硫酸的性质比较表
 项目 项目 名称 |
盐酸 |
硫酸 |
|
化学式 |
HCl
|
H2SO4 |
|
颜色,气味 |
浓HCl无色、有刺激性气味
|
浓H2SO4无色无味 |
|
挥发性 |
浓HCl易挥发(在空气中形成白雾) |
不挥发 。有吸水性、脱水性 |
|
与指示剂作用 |
紫色石蕊变红 无色酚酞不变色 |
紫色石蕊变红 无色酚酞不变色 |
|
与活泼金属反应 (练习书写化学方程式,并注明基本类型,下同) |
Zn+2HCl=ZnCl2+H2↑ Mg+2HCl==MgCl2+H2↑ |
Fe+H2SO4=FeSO4+H2
↑ 2Al+3H2SO4 ==Al2(SO4)3+3H2↑ |
|
与金属氧化物反应 |
CuO+2HCl=CuCl2+H2O Fe2O3+6HCl==2FeCl3+3H2O |
Al2O3+3H2SO4=Al2(SO4)3+3H2O
ZnO+ H2SO4==ZnSO4+H2O |
|
与碱的反应 |
NaOH+HCl=NaCl+H2O Mg(OH)2+2HCl==MgCl2+2H2O |
Ca(OH)2+H2SO4=CaSO4+2H2O 2Fe(OH)3+3H2SO4==Fe2(SO4)3+6H2O |
|
与某些盐反应 |
AgNO3+HCl=AgCl↓+HNO3 CaCO3+2HCl=CaCl2+H2O+CO2↑ NaHCO3+HCl=NaCl+H2O+CO2↑ |
Ba(NO3)2+H2SO4 =BaSO4
↓ +2HNO3 K2CO3+H2SO4= K2 SO4+ H2O+ CO2↑ |
|
鉴别试剂 |
AgNO3
溶液和稀HNO3 |
BaCl2溶液或Ba(NO3)2溶液和稀HNO3 |
附表3 氢氧化钠的化学性质
|
实验步骤 |
实验现象 |
实验结论(或化学方程式) |
1、 与指示剂的反应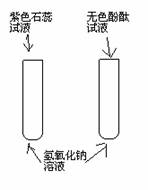 |
紫色石蕊试液变(蓝)色 无色酚酞试液变(红)色 |
氢氧化钠溶液使紫色石蕊试液变(蓝 )色, 氢氧化钠溶液使无色酚酞试液变(红 )色 |
2、与盐溶液的反应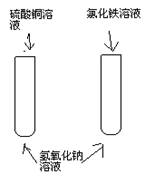 1 2 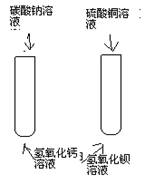 3 4 |
1、产生(蓝 )色沉淀 2、产生(红褐 )色沉淀 3、产生(白 )色沉淀 4、产生(蓝、白)色沉淀 |
化学方程式 1、CuSO4+2NaOH==Cu(OH)2↓+Na2SO4 2、FeCl3+3NaOH==Fe(OH)3↓+3NaCl 3、Ca(OH)2+Na2CO3==CaCO3↓+2NaOH 4、CuSO4+Ba(OH)2==Cu(OH)2↓+BaSO4↓ |
附表4 氢氧化钠与氢氧化钙的性质比较表
 用途 用途性质 |
氢氧化钠 |
氢氧化钙 |
|
化学式 |
NaOH |
Ca(OH)2 |
|
俗名 |
烧碱 火碱 苛性钠 |
熟石灰 消石灰 |
|
物理性质 |
1、 白色固体 2、 具有吸水性(易潮解) 3、 极易溶于水,放热 4、 具有强腐蚀性 |
1、 白色固体 2、 微溶于水 3、 具有腐蚀性 |
|
工业制法 |
Ca(OH)2+
Na2CO3= CaCO3↓+2NaOH (纯碱) |
高温 CaCO3===== CaO +、CO2↑ CaO + H2O == Ca(OH)2(剧烈反应,放出大量热,白色块状固体变成粉末) |
|
化学性质 |
1、 使紫色石蕊试液变蓝色,使无色酚酞试液变红色 2、 与某些非金属氧化物反应 2NaOH +CO2=Na2CO3+H2O 2NaOH +SO2=Na2SO3+H2O 2NaOH +SO3=Na2SO4+H2O (工业上吸收废气) 3、与酸反应 NaOH +HCl=NaCl+H2O 2NaOH+H2SO4==Na2SO4+2H2O NaOH+HNO3==NaNO3+H2O 4、与某些盐反应 2NaOH+CuSO4=Cu(OH)2↓+Na2SO4 MgCl2+2NaOH==Mg(OH)2↓+2NaCl Zn(NO3)2+2NaOH==Zn(OH)2↓ +2NaNO3 |
1、使紫色石蕊试液变蓝色,使无色酚酞试液变红色 2、与某些非金属氧化物反应 Ca(OH)2 +CO2=CaCO3↓ +H2O (用于鉴别CO2气体) 3、与酸反应(用于中和土壤酸性) Ca(OH)2+H2SO4=CaSO4+2H2O Ca(OH)2+2HCl==CaCl2+2H2O Ca(OH)2+H2SO4==CaSO4+2H2O 4、与某些盐反应 Ca(OH)2+Na2CO3=CaCO3 ↓+2NaOH Ca(OH)2+CuSO4=Cu(OH)2↓+CaSO4 (波尔多液的制取) Ca(OH)2+K2CO3=CaCO3 ↓+2KOH |
△盐的化学性质(1、2、3见上述内容)
2、几种碱在水中的解离方程式:
NaOH = Na+ + OH-
KOH = K+ + OH-
Ca(OH)2 = Ca2+ + 2OH-
1、 酸在水中的解离方程式进行总结归纳:
HCl = H+ + Cl-
H2SO 4 = 2H+ +SO42-
HNO3 = H+ +NO3-
金属活动性顺序:K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
|
反应方程式 |
基本类型 |
反应现象 |
用途 |
|
|
金属+ O2→金属氧化物 |
4Al+3O2=====2Al2O3 |
化合 |
∕ |
常温下铝表面形成致密氧化膜 |
|
△ 2Zn+O2=====2ZnO |
化合 |
∕ |
/ |
|
|
△ 2Cu+O2=====2CuO |
化合 |
红色固体变成黑色固体 |
/ |
|
|
金属+酸→盐+ H2 |
Fe+H2SO4
==FeSO4+H2↑ |
置换 |
铁钉表面有少量无色气泡生成,无色溶液逐渐变成浅绿色 |
/ |
|
Zn+H2SO4==ZnSO4+H2↑ |
置换 |
反应较剧烈,产生无色气泡,锌粒逐渐溶解; |
实验室制取H2 |
|
|
Mg+2HCl==MgCl2+H2↑ |
置换 |
反应剧烈,产生大量无色气泡,镁条溶解; |
/ |
|
|
金属+盐→盐+金属 |
Fe+CuSO4==FeSO4+Cu |
置换 |
铁钉表面有红色物质生成,蓝色溶液逐渐变成浅绿色 |
古代湿法制Cu |
|
2Al+3CuSO4 ==Al2(SO4)3
+3Cu |
置换 |
铝片表面有红色物质生成,蓝色溶液逐渐变成无色 |
/ |
|
|
Cu+ 2AgNO3 ==Cu(NO3)2+
2Ag |
置换 |
铜片表面有黑色物质生成,无色溶液逐渐变成浅蓝色 |
/ |
|
反应方程式 |
基本类型 |
反应现象 |
用途 |
|
CaCO3+2HCl==CaCl2+H2O+CO2↑ |
复分解 |
产生无色气泡,大理石逐渐溶解 |
实验室制取CO2,在大理石上"刻字" |
|
Na2CO3+2HCl==2NaCl+H2O+CO2↑ |
复分解 |
反应剧烈,产生大量气泡,白色固体溶解 |
可治疗胃酸过多 |
|
CaCO3+H2SO4==CaSO4+H2O+CO2↑ |
复分解 |
开始产生无色气泡,过一会儿,反应逐渐停止 大理石与硫酸在常温下反应,生成微溶于水的CaSO4、水和CO2,微溶的CaSO4会包住大理石,使反应停止(一般不用于制CO2) |
|
|
高温 CaCO3====CaO+CO2↑ |
分解 |
/ |
工业上用石灰石制取生石灰、CO2 |
2.与(中)强碱的反应
|
反应方程式 |
基本类型 |
反应现象 |
用途 |
|
Ca(OH)2+CO2===CaCO3↓+H2O |
∕ |
产生白色沉淀.(石灰水变浑浊) |
用石灰浆粉刷墙壁;实验室检验CO2 |
|
2NaOH+CO2==Na2CO3+H2O |
∕ |
无明显现象 |
工业上吸收废气 |
1. 与H2O反应
|
反应方程式 |
基本类型 |
反应现象 |
用途 |
|
CO2+H2O==H2CO3 |
化合 |
将CO2通入紫色石蕊溶液,溶液变红 |
制碳酸饮料 |
|
△ H2CO3===H2O+CO2↑ |
分解 |
加热上述溶液产生气泡,且变回紫色 |
(H2CO3不稳定) |
2. 还原性
|
反应方程式 |
基本类型 |
反应现象 |
用途 |
|
△ CuO+CO====Cu+CO2 |
/ |
黑色的CuO逐渐变成红色的Cu,且生成一种使澄清石灰水变浑浊的无色气体 |
还原CuO(冶炼铜) |
|
高温 Fe2O3+3CO====2Fe+3CO2 |
/ |
/ |
还原Fe2O3(炼铁) |
|
高温 Fe3O4+4CO====3Fe+4CO2 |
/ |
/ |
还原Fe3O4(炼铁) |
|
对比: △ H2+CuO====Cu+H2O |
置换 |
黑色固体变红色,管壁有水珠 |
精练Cu |
1. 可燃性
|
反应方程式 |
基本类型 |
反应现象 |
用途 |
|
点燃 2CO+O2=====2CO2 |
化合 |
一氧化碳在空气中燃烧,发出蓝色火焰,并放出热量,燃烧后生成的无色气体能使澄清石灰水变浑浊 |
煤气主要成分,做燃料 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com