
7.(2010·宝鸡模拟)已知NH4++AlO2-+2H2O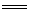 Al(OH)3↓+NH3·H2O,向含有等物质的量的NH4+、Al3+、H+混合溶液中,慢慢滴加NaOH溶液,直至过量,并不断搅拌,依次发生了数个离子反应,则第三个离子反应是( )。
Al(OH)3↓+NH3·H2O,向含有等物质的量的NH4+、Al3+、H+混合溶液中,慢慢滴加NaOH溶液,直至过量,并不断搅拌,依次发生了数个离子反应,则第三个离子反应是( )。
A.H++OH-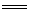 H2O
H2O
B.Al3++3OH-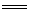 Al(OH)3↓
Al(OH)3↓
C.Al(OH)3+OH-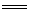 AlO2-+2H2O
AlO2-+2H2O
D.NH4++OH-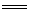 NH3·H2O
NH3·H2O
[解析]选D。通常来说溶液中的离子反应以H+与OH-间的中和反应速率最快,其它则需根据某些原理分析。故第一个反应为中和反应:H++OH-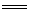 H2O,第二个反应为:Al3++3OH-
H2O,第二个反应为:Al3++3OH-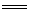 Al(OH)3↓,但发生第二个反应后,又出现两性Al(OH)3与NH4+何者优先反应的问题。若Al(OH)3优先与OH-反应,则产物AlO2-能够与NH4+又发生题给的双水解反应而不能共存又变回Al(OH)3,故第三个反应为NH4++OH-
Al(OH)3↓,但发生第二个反应后,又出现两性Al(OH)3与NH4+何者优先反应的问题。若Al(OH)3优先与OH-反应,则产物AlO2-能够与NH4+又发生题给的双水解反应而不能共存又变回Al(OH)3,故第三个反应为NH4++OH-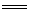 NH3·H2O。最后一个离子反应为Al(OH)3+OH-
NH3·H2O。最后一个离子反应为Al(OH)3+OH-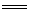 AlO2-+2H2O。
AlO2-+2H2O。
6.(2010·常熟模拟)某混合溶液中所含离子的浓度如下表,则M离子可能为( )。
|
所含离子 |
NO3- |
SO42- |
H+ |
M |
|
浓度/(mol·L-1) |
2 |
1 |
2 |
1 |
A.Cl- B.Ba2+ C.F- D.Mg2+
[解析]选D。阴离子所带的负电荷的浓度为:1×2mol·L-1+2×1mol·L-1=4mol·L-1,阳离子所带的正电荷浓度为:1×2mol·L-1,根据电荷守恒M应带两个单位正电荷,而Ba2+与SO42-不共存,所以M为Mg2+。
5.(2010·温州模拟)常温下,若溶液中由水电离产生的c(H+)、c(OH-)满足c(H+)·
c(OH-)=10-24 ,则下列各组离子在该溶液中一定可以大量共存的是( )。
A.Al3+、Na+、NO3-、Cl- B.K+、Na+、Cl-、NO3-
C.K+、Na+、Cl-、AlO2- D.K+、NH4+、SO42-、NO3-
[解析]选B。水电离产生的c(H+)、c(OH-)满足c(H+)·c(OH-)=10-24 ,即水的电离逆向移动,该溶液为强酸或强碱性溶液,题目要求一定可以大量共存,即在强酸或强碱性溶液中均可以大量共存,A项中的Al3+在碱性溶液中不能大量共存;C项中的AlO2-在酸性溶液中不能大量共存;D项中的NH4+在碱性溶液中不能大量共存。
4.(2010·忻州模拟)如图所示有6个编号,每个编号代表下列物质中的一种,凡是用直线相连的两种物质均能发生化学反应。供填写的物质有:a.Na2CO3溶液b.MgSO4溶液c.BaCl2溶液d.稀H2SO4e.铁f.Cu(NO3)2溶液。则图中③表示的物质的编号是( )。
A.e B.f C.a D.d
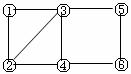
[解析]选C。本题考查元素及其化合物的性质。由图可知与③反应的物质最多,而题所给信息中,Na2CO3除铁之外与其他物质都反应,可知③为Na2CO3。
3.(2010·金华模拟)KHSO4、BaCl2、Na2CO3、FeSO4和氯水五种溶液,有下图所示的相互反应,图中每条连线两端的物质可以发生化学反应。下列说法不合理的是( )。
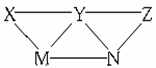
A.X一定为KHSO4
B.Y一定为Na2CO3
C.Z可能是氯水
D.M、N必定各为BaCl2、FeSO4中的一种
[解析]选A。本题以简洁的框图形式综合考查了无机元素化合物之间的反应关系,该题属于中档题。本题可采用表格法:
|
|
Na2CO3 |
KHSO4 |
FeSO4 |
BaCl2 |
氯水 |
|
Na2CO3 |
|
反应 |
反应 |
反应 |
反应 |
|
KHSO4 |
反应 |
|
不反应 |
反应 |
不反应 |
|
FeSO4 |
反应 |
不反应 |
|
反应 |
反应 |
|
BaCl2 |
反应 |
反应 |
反应 |
|
不反应 |
|
氯水 |
反应 |
不反应 |
反应 |
不反应 |
|
再从题中转化关系图分析可把五种物质分成三类,X、Z均能同时发生两个反应、M、N均能同时发生三个反应、而Y却能发生四个反应,故Y一定是Na2CO3溶液,X、Z只能是KHSO4溶液或氯水中的某一种,M、N只能是FeSO4溶液或BaCl2溶液中的某一种。
2.(2010·福建三明模拟)在某未知溶液中检验出含有Ba2+、NO3-,且溶液的pH=1。某学生还需鉴定此溶液中是否大量存在:①Al3+;②NH4+;③Fe2+;④Cl-;⑤AlO2-;
⑥SO42-,其实这些离子中有一部分不必再鉴定就能加以否定,你认为不必再鉴定的离子组是( )。
A.③⑤⑥ B.④⑤⑥ C.①②⑤ D.①③④
[解析]选A。溶液的pH=1,说明为强酸性溶液,溶液中一定不存在AlO2-;溶液中含有Ba2+、NO3-,显强氧化性,则一定不存在Fe2+、SO42-。
1.(2010·葫芦岛模拟)下列各组离子在指定环境下能大量共存的是( )。
A.pH=1的溶液中:Na+、S2-、K+、MnO4-
B.pH=7的溶液中:Al3+、Cl-、SO42-、HCO3-
C.pH>7的溶液中:Na+、AlO2-、SO42-、K+
D.pH=0的溶液中:Na+、K+、Fe2+、ClO-
[解析]选C。pH=1的溶液呈强酸性,故S2-不能存在,且在酸性条件下,MnO4- 具有强氧化性也能氧化S2-;Al3+与HCO3-相互促进水解而不能大量共存;pH=0时,溶液呈强酸性,ClO-具有强氧化性,能把Fe2+氧化成Fe3+。
6.在一固定容积的密闭容器中,保持一定温度,在一定条件下进行如下反应A(g)+2B(g)  3C(g),已知起始时加入1molA(g)和3mol
B(g),达平衡后,生成amol C(g).
3C(g),已知起始时加入1molA(g)和3mol
B(g),达平衡后,生成amol C(g).
(1) 当反应达到平衡时,C(g)在反应混合气中的体积分数为___________(用字母a表示)
(2) 相同实验条件下,若在同一容器中改为开始加入2molA和6mol B,达平衡时 C的物质的量_______mol(用字母a表示)。此时C在反应混合物中的体积分数为_____________(填“增大”、“减少”、或“不变”).
(3) 相同实验条件下,若在同一容器中改为开始时加入2molA和8mol B,达平衡时,要求C在混合物中体积分数与(2)相同,则开始时还需加入___________molC
(4) 若同一容器中加入nmolA和3nmol B,则平衡时C的物质的量为mmol 。若改变实验条件,可以使C的物质的量在m-2m间变化,则n与m的关系是____________________(用字母关系表示)
5.在一固定体积的密闭容器中,保持一定温度进行以下反应H2(g)+ I2(g)  2HI(g)已知加入1mol
H2(g)和21mol I2(g)时,达到平衡后生成amol HI(g)。在相同体条件下,保持平衡时各组分的体积分数不变,根据下表编号①-③的状态填空
2HI(g)已知加入1mol
H2(g)和21mol I2(g)时,达到平衡后生成amol HI(g)。在相同体条件下,保持平衡时各组分的体积分数不变,根据下表编号①-③的状态填空
|
已知 编号 |
起始状态物质的量n/mol |
平衡时HI(g)的物质的量n/mol |
||
|
H2(g) |
I2(g) |
HI(g) |
||
|
1 |
2 |
0 |
a |
|
|
① |
2 |
4 |
0 |
|
|
② |
|
|
1 |
0.5a |
|
③ |
m |
g(>2m) |
|
|
答案:2a 0 0.5 2g-4m (g-m)a
6.在密闭容器中,aA(气) bB(气)达平衡后,保持温度不变,将容器体积增加1倍,当达到新平衡时,B的浓度是原来的60%,下列说法正确的是:
bB(气)达平衡后,保持温度不变,将容器体积增加1倍,当达到新平衡时,B的浓度是原来的60%,下列说法正确的是:
A.平衡向正反应方向移动了; B.物质A的转化率减少了;
C.物质B的质量分数增加了; D.a>b;
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com