
5.圆褐固氮菌所固定的氮素参与氮循环的全过程,下列表述正确的是 ( )
A.N2→NH3→NO3-→生物体有机氮→NH3→NO3-→N2
B.N2→NH3→生物体有机氮→NH3→NO3-→N2
C.N2→NH3→生物体有机氮→NO3-→N2
D.N2→NH3→NO3-→生物体有机氮→NH3→N2
4.下列关于甘蔗、玉米叶片结构及光合作用过程的叙述,正确的是 ( )
① 围绕着维管束的叶肉细胞排列疏松
② 因为叶肉细胞的叶绿体有正常的基粒,所以,水的光解发生在叶肉细胞
③ NADPH储存了能量,并具有还原性
④ CO2中的C首先转移到C4中,然后才转移到C3中
⑤ 光能转化为电能时,电子的最终受体是ATP和NADP+
A.①③⑤ B.①①③④ C.②④⑤ D.②③④
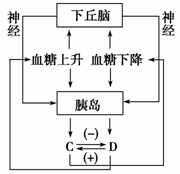
3.右图为血糖的生理调节过程,下列分析错误的是( )A.血糖升高可直接刺激胰岛分泌C,从而使血糖降低的过程属于体液调节
B.血糖下降刺激下丘脑,通过神经支配胰岛分泌D,从而使血糖上升的过程属于神经调节
C.C是胰岛素,D是胰高血糖素,C、D维持血糖稳定,表现为拮抗作用
D.血糖平衡是神经调节与体液调节共同作用的结果
2.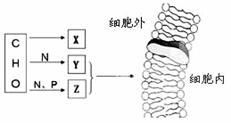 下图X、Y、Z是细胞中的三种化合物,X为细胞的主要能源物质,Y、Z是构成细胞膜的主要成分。下列有关说法正确的是( )
下图X、Y、Z是细胞中的三种化合物,X为细胞的主要能源物质,Y、Z是构成细胞膜的主要成分。下列有关说法正确的是( )
A.细胞膜会被蛋白酶分解,说明组成细胞膜
的物质中有Z
B.细胞的识别与细胞膜上Y和X的结合物
有关
C.维生素D可优先通过细胞膜扩散到细胞内
部与Y有关
 D.构成细胞膜的Y、Z都可以运动,说明细胞膜具有选择透过性
D.构成细胞膜的Y、Z都可以运动,说明细胞膜具有选择透过性
1.元素和化合物是细胞的物质基础,下列相关叙述正确的是( )
A.具有生物催化作用的酶都是由氨基酸组成的
B.ATP和染色体中含有的五碳糖都是核糖
C.一条由n个氨基酸组成的肽链中含有的氧原子数目至少为n+1个
D.由核糖体合成,经高尔基体加工成的具有生物活性的固氮酶,能将N2还原成NH3
2.用含Na2CO3的NaOH标准液滴定盐酸。
分析:若以酚酞作指示剂,由于1 mol HCl~40 g NaOH而1 mol HCl~106 g Na2CO3~80 g NaOH,所以这实际上相当于V(NaOH)变大了,最终导致c盐酸的值偏大。
试题枚举
[例1] 有①②③三瓶体积相等、浓度都是1 mol·L-1的HCl溶液,将①加热蒸发至体积减少一半,在②中加入少量CH3COONa固体(加入后溶液仍呈强酸性),③不作改变,然后以酚酞作指示剂,用NaOH溶液滴定上述三种溶液,所消耗的NaOH溶液的体积是( )
A.①=③>② B.③>②>①
C.③=②>① D.①=②=③
解析:这是一道有关化学实验、酸碱中和滴定、电离平衡移动、盐类水解等的综合题。“陷阱”设在①中,蒸发时溶液中的水分子和HCl分子将同时挥发出来,溶液中盐酸浓度要降低;对于②中加入CH3COONa固体,CH3COO-+H+ CH3COOH,但用NaOH溶液中和时,CH3COOH也同时被中和,所以消耗NaOH的体积不会变化。
CH3COOH,但用NaOH溶液中和时,CH3COOH也同时被中和,所以消耗NaOH的体积不会变化。
答案:C
[例2] 取相同体积(0.025 L)的两份0.01 mol·L-1 NaOH溶液,把其中一份放在空气中一段时间后,溶液的pH_________(填“增大”“减小”或“不变”),其原因是_________。
用已知浓度的硫酸溶液中和上述两份溶液,其中第一份(在空气中放置一段时间)所消耗硫酸溶液的体积为V(A),另一份消耗硫酸溶液的体积V(B),则:
(1)以甲基橙为指示剂时,V(A)和V(B)的关系是:_________;
(2)以酚酞为指示剂时,V(A)和V(B)的关系是:_________。
解析:NaOH溶液放置于空气中,因NaOH与空气中CO2反应造成NaOH减少,故溶液的pH减小。用H2SO4滴定Na2CO3溶液,反应分两个阶段进行:
①H++CO ====HCO
====HCO (此时溶液呈弱碱性)
(此时溶液呈弱碱性)
②H++HCO ====CO2↑+H2O(此时溶液呈弱酸性)
====CO2↑+H2O(此时溶液呈弱酸性)
滴定过程中,按哪种反应进行,取决于选择的指示剂。
(1)若选用甲基橙作指示剂,因其变色范围在pH=3.1-4.4。故滴定反应按②进行,由关系式:2NaOH Na2CO3
Na2CO3 CO2↑可知消耗的H2SO4量不变,故答案为V(A)=V(B)。
CO2↑可知消耗的H2SO4量不变,故答案为V(A)=V(B)。
(2)若选用酚酞作指示剂,酚酞的变色范围为pH=8-10,滴定反应按①进行,由关系式:2NaOH Na2CO3
Na2CO3 NaHCO3可知消耗H2SO4的量减少,故答案为V(A)<V(B)。
NaHCO3可知消耗H2SO4的量减少,故答案为V(A)<V(B)。
答案: 减小因NaOH与空气中CO2反应,造成NaOH减少,故溶液pH减小
(1)V(A)=V(B)
(2)V(A)<V(B)
[例3]测血钙的含量时,可将2.0 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀。 将沉淀用稀硫酸处理得H2C2O4后,再用KMnO4某酸性溶液滴定,氧化产物为CO2,还原产物为Mn2+,若终点时用去20.0 mL 1.0×10-4 mol·
L-1的KMnO4溶液。
(1)写出用KMnO4滴定H2C2O4的离子方程式_______________________。
(2)判断滴定终点的方法是________________________________________。
(3)计算:血液中含钙离子的浓度为________________________________g·mL-1。
解析:因为KMnO4溶液至反应完毕过量时,会使溶液呈紫色,故可用滴入一滴KMnO4酸性溶液由无色变为浅紫色且半分钟不褪色的方法来判断终点。由题意知可能发生反应的离子方程式为:2MnO +5H2C2O4+6H+====2Mn2++10CO2↑+8H2O、Ca2++C2O
+5H2C2O4+6H+====2Mn2++10CO2↑+8H2O、Ca2++C2O ====CaC2O4↓、CaC2O4+2H+====Ca2++H2C2O4。
====CaC2O4↓、CaC2O4+2H+====Ca2++H2C2O4。
设2 mL血液中含Ca2+的物质的量为x,则
5Ca2+-5CaC2O4-5H2C2O4-2MnO
5 2
x 20.0×10-3 L×1.0×10-4 mol·L-1
x=5.0×10-6 mol,1 mL血液中Ca2+的浓度为 =1.0×104 g·mL-1
=1.0×104 g·mL-1
答案: (1)2MnO +5H2C2O4+6H+====2Mn2++10CO2↑+8H2O
+5H2C2O4+6H+====2Mn2++10CO2↑+8H2O
(2)溶液由无色变为浅紫色,且半分钟内不褪色
(3)1.0×10-4
用固体配制标准液时,样品中含有杂质。
1.用盐酸滴定含Na2O的NaOH样品。
分析:由于1 mol HCl~40 g NaOH,而1 mol HCl~31 g Na2O,所以实际上相当于NaOH质量变大了,最终使w(NaOH)的值偏大。
3.滴至终点时滴定管尖嘴处半滴尚未滴下(或一滴标准液附着在锥形瓶内壁上未摆下)
分析:此时,假如把这半滴(或一滴)标准液滴入反应液中,肯定会超过终点。所以,这种情况会使c待测液的值偏大。
2.强碱滴定弱酸时,酚酞由无色变为粉红色时立即停止滴定(半分钟后溶液又变为无色)
分析:这属于过早估计终点,致使c待测液的值偏小。
1.强酸滴定弱碱时,甲其橙由黄色变为红色停止滴定。
分析:终点时的颜色变化应是由黄变橙,所以这属于过晚估计终点,致使c待测液的值偏大。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com