
20.(2010·上海静安区模拟)可以通过实验探究有关物质氧化性和还原性的强弱。
Ⅰ.探究有关物质氧化性的强弱。
已知Bi位于周期表中VA族,+3价较稳定,NaBiO3溶液为无色,Bi3+无色;Mn2+无色,MnO4-呈紫红色;Pb位于周期表中IVA族,+2价较稳定,PbSO4是一种白色沉淀。取一定量的Mn(NO3)2溶液依次进行实验,现象记录如下。
①滴加适量的NaBiO3溶液,溶液变为紫红色。
②继续滴加适量H2O2,紫红色褪去,并有气泡产生。
③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色。
④最后通入足量的SO2气体。
请回答下列问题:
(1)推测实验④中的现象为____________________________。
(2)分析上述现象,KMnO4、H2O2、PbO2氧化性由强到弱的顺序为________。
Ⅱ.探究镁、铝、铜金属单质还原性的强弱。
现有镁条、铝片、铝粉、铜片、氧化镁、氧化铝、氧化铁、盐酸、硝酸银溶液、硫酸铜溶液及其它常用的实验用品和仪器,根据现有药品,请你设计简单实验验证镁、铝、铜金属单质的还原性强弱。
依据你设计的实验方案,回答下列问题:
(3)实验原理:用化学方程式表示实验中的反应:
①________________________________________;
②________________________________________;
③________________________________________。
(4)实验现象:能够充分说明镁、铝、铜金属单质还原性强弱的明显现象是________。
[解析]Ⅰ.①向Mn(NO3)2溶液中滴加NaBiO3溶液时,溶液变为紫红色,说明有MnO4-生成,即Mn2+被氧化成MnO4-,NaBiO3溶液被还原成Bi3+,所以氧化性NaBiO3>KMnO4;②向所得到的KMnO4溶液中滴加H2O2,紫红色褪去,说明MnO4-被还原成Mn2+,H2O2被氧化成O2,所以氧化性KMnO4>H2O2;③向含Mn2+的溶液中加入PbO2固体,固体溶解,溶液又变为紫红色,说明Mn2+又被氧化成MnO4-,PbO2被还原成Pb2+,所以氧化性PbO2>KMnO4;④MnO4-可以将SO2氧化成SO42-,SO42-和Pb2+结合生成白色的PbSO4沉淀。
Ⅱ.镁、铝是活泼金属,能够和盐酸反应放出氢气,但是更活泼的镁反应更为剧烈;铜是不活泼金属,不能和盐酸反应放出氢气,但是可以和硝酸银溶液发生置换反应生成更不活泼的单质银。
[答案]
(1)紫红色褪去,生成白色沉淀
(2)PbO2>KMnO4>H2O2
(3)Mg+2HCl=MgCl2+H2↑ 2 Al+6HCl=2AlCl3+3H2↑
Cu+2AgNO3=Cu(NO3)2+2Ag
(4)镁条、铝片分别与盐酸反应时,镁条与盐酸反应更剧烈;铜和硝酸银溶液反应时,铜片表面有银白色物质析出。
()
19.(2010·上海浦东区模拟)已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。现有一氧化还原反应的体系中,反应物和生成物共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质:
(1)该反应中,化合价升高的反应物是____________,化合价没有发生变化的反应物是________________。
(2)写出一个包含上述七种物质的氧化还原反应方程式(需配平):
________________________________________________________________。
(3)上述反应中,1mol氧化剂在反应中_______(填“得到”或“失去”)____mol电子。
(4)如果在反应后的溶液中加入NaBiO3,溶液又变紫红色。说出NaBiO3的一个性质:_________________________________________。
[解析]根据题给信息KMnO4和盐酸反应生成氯气,而所给物质中KCl中含有Cl-,H2SO4中含有H+,所以反应物是KMnO4、KCl和H2SO4,生成物是K2SO4、MnSO4、Cl2和H2O。锰元素化合价由+7价变成+2价,化合价降低,被还原;氯元素的化合价由-1价变成0价,化合价升高,被氧化,根据化合价升降数相等可得如下配平的化学方程式:2KMnO4+10KCl+8H2SO4=6K2SO4+2MnSO4+5Cl2↑+8H2O。在反应后的溶液中加入NaBiO3,溶液又变紫红色,说明有MnO4-生成,即BiO3-将Mn2+氧化成MnO4-,所以NaBiO3具有强氧化性,其氧化性比KMnO4氧化性强。
[答案](1)KCl;H2SO4
(2)2KMnO4+10KCl+8H2SO4=6K2SO4+2MnSO4+5Cl2↑+8H2O
(3)得到;5
(4)NaBiO3具有强氧化性(比KMnO4氧化性强)
18.(2010·苏州模拟)一个完整的氧化还原反应方程式可以拆开,写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”。如2Fe3++Cu=2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e-=Cu2+,还原反应式:2Fe3++2e-=2Fe2+。据此,回答下列问题:
(1)将反应Zn+2H+=Zn2++H2↑拆写为两个“半反应式”:
氧化反应式:__________________,还原反应式:__________________。
(2)将反应3NO2+H2O=2H++2NO3-+NO拆写为两个“半反应式”:
氧化反应式:__________________,还原反应式:__________________。
(3)已知某反应的两个“半反应式”为:CH4+10OH--8e-=CO32-+7H2O,O2+2H2O+4e-=4OH-,则氧化还原反应方程式为__________________。
[解析](2)注意电子得失守恒、原子数目守恒以及物质的选择与化学计量数调整。在反应3NO2+H2O=2H++2NO3-+NO中,只有1个NO2分子作氧化剂,有2个NO2分子作还原剂。2个NO2分子变为2个NO3-离子时,需2个H2O分子提供2个O原子,2个H2O分子中的4个H原子则变为4个H+离子。1个NO2分子变成1个NO分子时,另1个O原子需要与2个H+结合生成水。(3)前式+后式×2即得。
[答案](1)Zn-2e-=Zn2+,2H++2e-=H2↑
(2)2NO2+2H2O-2e-=4H++2 NO3-;NO2+2 H++2e-=NO+H2O
(3)CH4+2O2+2OH-=CO32-+3H2O
17.(2010·云南师大附中模拟)煤炭中以FeS2形式存在的硫,在有水和空气及在脱硫微生物存在下发生生物氧化还原反应,有关反应的离子方程式依次为:
①2FeS2+7O2+2H2O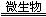 4H++2Fe2++____________;
4H++2Fe2++____________;
②4Fe2++O2+4H+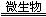 4Fe3++____________;
4Fe3++____________;
③FeS2+2Fe3+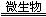 3Fe2++2S;
3Fe2++2S;
④2S+3O2+2H2O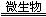 4H++2SO42-。
4H++2SO42-。
已知:FeS2中的硫元素为-1价。
回答下列问题:
(1)根据质量守恒定律和电荷守恒定律,将上述①②离子方程式补充完整。
(2)反应③的还原剂是__________________。
(3)观察上述反应,FeS2最终转化为____________从煤炭中分离出来
[解析](1)根据电荷守恒定律,反应①左边没有电荷,右边已有8个正电荷,还缺8个负电荷,结合质量守恒定律,反应物中还含有4个S和16个O,其个数比为1∶4,所以缺少4个SO42-。(2)根据电荷守恒定律,反应②左边有12个正电荷,右边已有12个正电荷,所以缺少一种电中性物质,结合质量守恒定律,反应物中还含有4个H和2个O,其个数比为2∶1,所以缺少2个H2O。(3)从上述四个反应可以看出,硫元素的变化过程为:FeS2→SO42-,FeS2→S→SO42-,所以硫元素最终变成SO42-;铁元素的变化过程为:FeS2→Fe2+→Fe3+→Fe2+,所以铁元素最终变成Fe2+;
[答案](1)①4SO42- ②2H2O(漏掉或写错系数每处扣1分)
(2)FeS2
(3)Fe2+和SO42-或FeSO4和H2SO4
16.(2010·腾冲模拟)下列图是一个实验示意图,方框表示有关的仪器,箭头表示液体或气体的流向。
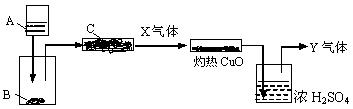
图中A是液体,B、C是固体。A与B反应后产生的气体经过C,得到纯气体X。X通过灼热CuO,CuO转化为Cu。气体再通过浓H2SO4,最后得到纯气体Y,Y是对环境没有污染的气体,大量排放也没有危险。
为进行以上实验,请从下列试剂范围内选择合适的A、B和C:浓硫酸、稀硫酸、浓硝酸、稀硝酸、浓盐酸、稀盐酸、锌粒、浓NaOH溶液、大理石、碱石灰、NH4Cl固体。
(1)A是________,B是________,C是________,X是________。
(2)写出A和B反应的化学方程式________________________________。
(3)写出X和CuO反应的化学方程式________________________________。
[解析]C应该是干燥剂,必然是碱石灰。由X+CuO Cu+Y+…,CuO被还原,说明X具有还原性,结合A+B→X,锌粒和浓硫酸、浓硝酸、稀硝酸产生的SO2、NO2、NO及大理石和稀盐酸产生的CO2不能将CuO还原,所以X可能是锌粒和稀盐酸产生的H2或浓NaOH溶液和NH4Cl固体产生的NH3。若X是H2,则它和CuO反应后生成的水蒸气能够被浓H2SO4完全吸收,最后不可能有气体剩余;若X是NH3,则它将被CuO氧化成N2,反应生成的水蒸气被浓H2SO4完全吸收,最后有N2剩余。由此可以得到答案。
Cu+Y+…,CuO被还原,说明X具有还原性,结合A+B→X,锌粒和浓硫酸、浓硝酸、稀硝酸产生的SO2、NO2、NO及大理石和稀盐酸产生的CO2不能将CuO还原,所以X可能是锌粒和稀盐酸产生的H2或浓NaOH溶液和NH4Cl固体产生的NH3。若X是H2,则它和CuO反应后生成的水蒸气能够被浓H2SO4完全吸收,最后不可能有气体剩余;若X是NH3,则它将被CuO氧化成N2,反应生成的水蒸气被浓H2SO4完全吸收,最后有N2剩余。由此可以得到答案。
[答案](1)浓NaOH溶液 NH4Cl固体 碱石灰 NH3
(2)NaOH+NH4Cl NaCl+NH3↑+H2O
NaCl+NH3↑+H2O
(3)2NH3+3CuO 3Cu+N2+3H2O。
3Cu+N2+3H2O。
15.(2010·包头模拟)已知浓H2SO4和Fe3+都可以将Cu氧化(Fe3+与Cu的反应为:2Fe3++Cu=2Fe2++Cu2+),浓H2SO4还可以将Br-氧化成Br2,Fe与Br2反应生成FeBr3,则有关物质氧化性强弱的顺序为( )。
A.H2SO4(浓)>Cu2+>Fe3+>Br2 B.H2SO4(浓)>Br2>Fe3+>Cu2+
C.Br2>H2SO4(浓)>Cu2+>Fe3+ D.Cu2+>Fe3+>Br2>H2SO4(浓)
[解析]选B。在氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,据此判断出各个反应的氧化剂和氧化产物即可得到答案。
14.(2010·宁波模拟)新型纳米材料氧缺位铁酸盐(MFe2Ox)(3<x<4;M表示Mn、Co、Zn或Ni的二价离子),常温下,它能使工业废气中的SO2、NO2等氧化物转化为单质。转化流程如图所示:

有关上述转化过程的下列叙述正确的是( )。
A.MFe2O4表现了还原性 B.MFe2Ox表现了还原性
C.SO2和NO2表现了还原性 D.SO2和NO2发生了分解反应
[解析]选B。MFe2Ox能使SO2、NO2转化为单质,即SO2→S、NO2→N2,在该转化过程中,硫元素和氮元素的化合价降低,被还原,发生还原反应,作氧化剂,表现氧化性;则MFe2Ox在反应中作还原剂,表现还原性,MFe2O4表现氧化性。
13.(2010·运城模拟)铅的冶炼大致过程如下:①富集:将方铅矿(PbS)进行浮选;②焙烧:2PbS+3O2 2PbO+2SO2;③制粗铅:PbO+C
2PbO+2SO2;③制粗铅:PbO+C Pb+CO;PbO+CO
Pb+CO;PbO+CO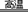 Pb+CO2。下列说法正确的是( )。
Pb+CO2。下列说法正确的是( )。
A.浮选法富集方铅矿的过程属于化学变化
B.方铅矿焙烧反应中,PbS是还原剂,还原产物只有PbO
C.整个冶炼过程中,制取1mol Pb共转移2mol电子
D.将1mol PbS冶炼成Pb理论上至少需要6g碳
[解析]选D。浮选法富集方铅矿的过程属于物理变化,A选项错误;方铅矿焙烧反应中,铅元素的化合价没有发生变化,硫元素的化合价升高,被氧化,氧元素的化合价降低,被还原,所以还原剂是PbS,氧化剂是O2,氧化产物是SO2,还原产物是PbO和SO2,B选项错误;整个冶炼过程中的反应物是PbS、O2和C,生成物是Pb、SO2和CO2,总反应方程式为2PbS+3O2+C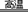 2Pb+2SO2+CO2,该反应转移12个电子,所以制取1mol Pb共转移6mol电子,C选项错误;制取1mol
Pb需要0.5mol C,即0.5mol×12g/mol=6g,D选项正确。
2Pb+2SO2+CO2,该反应转移12个电子,所以制取1mol Pb共转移6mol电子,C选项错误;制取1mol
Pb需要0.5mol C,即0.5mol×12g/mol=6g,D选项正确。
12.(2010·辽阳模拟)今有三个氧化还原反应:
①2FeCl3+2KI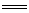 2FeCl2+I2+2KCl
2FeCl2+I2+2KCl
②2FeCl2+Cl2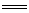 2FeCl3
2FeCl3
③2KMnO4+16HCl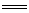 2MnCl2+2KCl+5Cl2↑+8H2O
2MnCl2+2KCl+5Cl2↑+8H2O
若某溶液中有Fe2+、I-和Cl-共存,要氧化除去I-而不影响Fe2+和Cl-,可加入的试剂
是( )。
A.Cl2 B.KMnO4 C.FeCl3 D.HCl
[解析]选C。根据反应①可得氧化性,FeCl3>I2,根据反应②可得氧化性:Cl2>FeCl3,根据反应③可得氧化性:KMnO4>Cl2,则氧化性:KMnO4>Cl2>FeCl3>I2,本题中要氧化I-而不影响Fe2+和Cl-,必须选氧化能力比I2强,而比Cl2弱的氧化剂,只有FeCl3满足条件。
11.(2010·肇庆模拟)在含有FeBr2和FeI2的混合溶液中,通入一定量的Cl2,再滴加KSCN溶液后,溶液变为血红色,则混合溶液中最有可能不存在的离子是( )。
A.Cl- B.Fe2+ C.I- D.Br-
[解析]选C。滴加KSCN溶液后,溶液变为血红色,说明溶液中含有Fe3+,即Fe2+被氧化,因为还原性:I->Fe2+>Br-,所以I-一定全部被氧化,溶液中不可能含有I-。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com