
16.阿伏加德罗常数约为6.02×1023mol-1,下列叙述正确的是
A.2.24LCO2中含有的原子数为0.3×6.02×1023
B.0.1L 3mol·L-1的NH4NO3溶液中含有的NH4+数目一定小于0.3×6.02×1023
C.5.6g铁粉与硝酸反应失去的电子数一定为0.3 ×6.02×1023
D.4.5gSiO2晶体中含有的硅氧键数目为0.3×6.02×1023
第二卷:非选择题
15.下列离子方程式正确的是
A.二氧化氮溶于水:3NO2+H2O=2H++2NO3-+NO
B.将标准状况下112 mL氯气通入10 mL 1 mol·L-1的溴化亚铁溶液中: 2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2
C.次氯酸钙溶液中通入过量二氧化碳: Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO
D.氨水和醋酸溶液混合:NH3·H2O+CH3COOH=NH +CH3COO-+H2O
+CH3COO-+H2O
14.自然界中某些矿物的形成过程会发生如下反应:
 ,下列说法正确的是
,下列说法正确的是
A. FeS2只作还原剂,CuSO4只作氧化剂 B. 5mol FeS2发生反应,有21mol电子转移
C.
产物中的 离子都是氧化产物
D. Cu2S是还原产物
离子都是氧化产物
D. Cu2S是还原产物
13.已知酸式盐NaHB在水溶液中存在下列反应:
①NaHB=Na++HB-,②HB-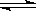 H++B2-,
H++B2-,
③HB-+H2O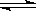 H2B+OH-,
H2B+OH-,
且溶液中c(H+)< c(OH-),则下列说法一定正确的是
A、NaHB为强电解质 B、H2B为强酸
C、Na2B溶液pH<7 D、HB-的电离程度小于HB-的水解程度
12.如图所示,杠杆AB两端分别挂有体积相同.质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入M的浓溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑两球的浮力变化)
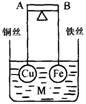 A.当M为盐酸、杠杆为导体时,A端高,B端低
A.当M为盐酸、杠杆为导体时,A端高,B端低
B.当M为CuSO4、杠杆为导体时,A端低,B端高
C.当M为CuSO4、杠杆为绝缘体时,A端低,B端高
D.当M为AgNO3、杠杆为导体时,A端高,B端低
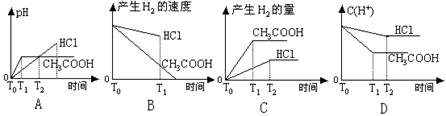
11.在体积都为1L,pH=2的盐酸和醋酸溶液中,投入0.65g锌粒,则下图所示比较符合客观事实的是(醋酸的电离常数K=1.75×10-5)
9.下表是几种物质在不同温度下的溶解度,工业上将等物质的量的NaCl、CO2、NH3溶于适量水中,在30℃时配成溶液,此时溶液无晶体,当降致某温度时,开始析出晶体。此晶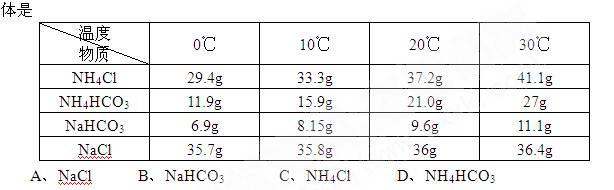 10.下列各种情况下,溶液中能大量存在的离子组是
10.下列各种情况下,溶液中能大量存在的离子组是
A.由水电离出的c(H+)=l×10-12mol/L的溶液中:K+、Ba2+、Cl-、NO3-
B.澄清透明的溶液中:I-、Cl-、ClO-、NH4+
C.使pH试纸呈红色的溶液中:K+、Fe2+、NO3-、MnO4-
D.可溶解铝粉的溶液中:K+、Mg2+、SO32-、SO42-
7.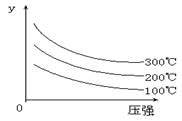 某可逆反应L(s)+G(g)
某可逆反应L(s)+G(g)  3R(g); △H>0,如图表示外界条件温度、压强的变化对上述反应的影响。试判断图中y轴不可以表示
3R(g); △H>0,如图表示外界条件温度、压强的变化对上述反应的影响。试判断图中y轴不可以表示
A.平衡混合气中R的质量分数
B.达到平衡时G的转化率
C.平衡混合气中G的质量分数
D.达到平衡时L的转化率
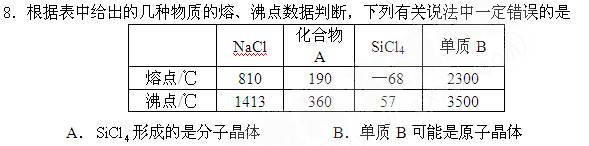 C.电解NaCl水溶液可制得金属钠 D.化合物A可能是分子晶体
C.电解NaCl水溶液可制得金属钠 D.化合物A可能是分子晶体
6.室温下,等体积、都是0.5mol/L的①NaCl ②AlCl3 ③HF ④K2CO3四种物质的水溶液中,所含阳离子数目由少到多的顺序是
A.③①④② B.③①②④ C.①④③② D.④②①③
5.某有机物能使溴水褪色,也能在一定条件下发生水解生成两种有机物,还能发生加聚反应生成高分子化合物,则此有机物中一定含有下列基团的组合是
①-CH3;②-OH;③-Cl;④-CHO;⑤-C2H3;⑥-COOH;⑦-COOCH3
A、③⑤ B、②⑥ C、⑤⑦ D、④⑤
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com