
22.(10分)钠是一种很活泼的金属,在工业上常用电解熔融NaCl的方法制得,其另一产物氯气的用途也十分广泛,工业上制取漂白粉就是其用途之一。
(1)请写出工业上用电解方法制取钠的化学方程式 。
(2)工业上制取漂白粉的化学反应方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,漂白粉的主要成分是 、 。
(3)实验室有一瓶密封不严的漂白粉,其中肯定存在CaCl2,请设计实验,探究该固体中可能存在的其它物质。
①提出合理假设。
假设1:该漂白粉未变质,只含 ;
假设2:该漂白粉全部变质,只含 ;
假设3:该漂白粉部分变质,既含有Ca(ClO)2又含有CaCO3。
② 设计实验方案,进行实验。请在答题卡上写出实验步骤、预期现象与结论
限选用的仪器和药品:试管、滴管、带导管的单孔塞、蒸馏水、自来水、1mol/LHCl、品红溶液、新制澄清石灰水。(提示:不必检验Ca2+和Cl-,表格可以不填满。)
|
实验步骤 |
预期现象和结论 |
|
|
① |
取少量上述漂白粉于试管中, |
|
|
② |
|
|
|
③ |
|
|
21.(8分)将浓度为C1的浓硫酸50g(溶质的质量分数为w1)与VmL水混合,得到物质的量浓度为C2的稀硫酸(溶质的质量分数为w2)(以下填“>”、“<”或“=”)
⑴若w1=2w2,则C1 2C2,V 50mL。
⑵若C1 =2C2,则w1 2w2, V 50mL。
20.(8分)已知氧化性BrO3―> ClO3―>Cl2>IO3―>I2。现将饱和氯水逐滴滴入KI淀粉溶液中至过量。
⑴可观察到的现象是: ① ;② 。
⑵写出有关离子方程式:① ;
② 。
19.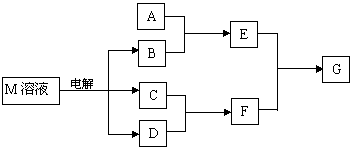 (10分)已知物质M由X、Y两种短周期元素且同周期元素组成,X原子的最外层电子数是最内层电子数的一半,Y元素最高正价与它的最低负价代数和为6。M与其它物质的转化关系如下(部分产物已略去)
(10分)已知物质M由X、Y两种短周期元素且同周期元素组成,X原子的最外层电子数是最内层电子数的一半,Y元素最高正价与它的最低负价代数和为6。M与其它物质的转化关系如下(部分产物已略去)
(1)若A是X、Y同周期元素的一种单质,当F的水溶液过量时,G为可溶性盐,当F的水溶液不足时,G为沉淀,则E与过量F溶液反应的离子方程式是 。
(2)若A是一种常见酸性氧化物,且可用于制造玻璃,则A与B反应的化学方程式是 。
(3)若A是一种常见化肥,其水溶液呈酸性,且E与F反应生成G时有白烟产生,则溶液中A与B加热时反应的离子方程式是 。
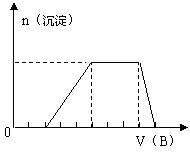 (4)若A是一种溶液,只可能含有H+、NH4+、
(4)若A是一种溶液,只可能含有H+、NH4+、
Mg2+、Fe3+、A13+、CO32-、SO42-中的某些
离子,当向该溶液中加入B溶液时,发现
生成沉淀的物质的量随B溶液的体积变化
如图所示,由此可知,该溶液中肯定含有
的阳离子是 ,且各阳离子的物质的量之比为 。
18.碳酸铜和碱式碳酸铜[Cu2(OH)2CO3]均可溶于盐酸转化为氯化铜。在高温下这两种化合物均能分解生成氧化铜。溶解28.4 g 的上述混合物,恰好消耗1.0 mol·L-1盐酸 500 mL。灼烧等量的上述混合物,得到的氧化铜质量是( )
A.15 g B.20 g C. 30 g D.40 g
第Ⅱ卷 非选择题(共46分)
17. 在一定温度下,已知有关某饱和溶液的一些数据:①溶液的质量,②溶剂的质量,③溶液的体积,④溶质的摩尔质量,⑤溶质的溶解度,⑥溶液的密度.利用下列各组数据计算该饱和溶液的物质的量浓度,不能算出的一组( )
A.④⑤⑥ B.①②③④ C.①④⑥ D.①③④⑤
16.高铁酸钾(K2FeO4 )是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强,无二次污染的绿色水处理剂。工业上是先制得高铁酸钠,然后在低温下,在高铁酸钠溶液中加入KOH至饱和就可析出高铁酸钾(K2FeO4)。
湿法制备的主要反应方程为:2Fe(OH)3+3ClO― +4OH―=2FeO42-+3Cl― +5H2O
干法制备的主要反应方程为:2FeSO4+4Na2O2=2Na2FeO4 +2Na2SO4
下列有关说法不正确的是( )
A.干法中每生成1mol Na2FeO4转移4 mol电子
B.湿法中每生成1mol Na2FeO4转移3 mol电子
C.高铁酸钾中铁显+3价
D.K2FeO4 处理水时,既能消毒杀菌,还能吸附水中的悬浮杂质
15. X、Y、Z为三种单质。已知:Y能将Z从其化合物的水溶液中置换出来,而Z又能将X从其化合物中置换出来。由此可以推断下列说法中可能正确的是( )
①单质的氧化性:Y>Z>X; ②单质的还原性:Y>Z>X;
③对应离子的氧化性:X>Z>Y; ④对应离子的还原性:X>Z>Y
A.只有① B.只有②③ C.只有①④ D.①②③④
14.在常温常压下,已知:4Fe(s) + 3O2(g) = 2Fe2O3(s); ΔH1
4Al(s) + 3O2(g) = 2Al2O3(s); ΔH2
2Al(s) + Fe2O3(s) = Al2O3(s) + 2Fe(s); ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是( )
A.ΔH3= (ΔH1+ΔH2)
B.ΔH3=ΔH2-ΔH1
(ΔH1+ΔH2)
B.ΔH3=ΔH2-ΔH1
C.ΔH3=2(ΔH2+ΔH1)
D.ΔH3= (ΔH2-ΔH1)
(ΔH2-ΔH1)
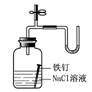
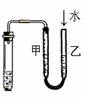
13.下列装置或操作能达到实验目的的是( )


|
A.①②③④ B.③④ C.②③④ D.①②
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com