
18.(09海南卷 6)已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是:
6)已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是:
 A.该溶液的pH=4
A.该溶液的pH=4
 B.升高温度,溶液的pH增大
B.升高温度,溶液的pH增大
 C.此酸的电离平衡常数约为1×10-7
C.此酸的电离平衡常数约为1×10-7
 D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍
D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍
答案:B
解析:c(H+)=c(HA)α=0.1×0.1%=10-4,因此pH=4,A正确;弱电解质电离是吸热的,因此升温HA电离程度增大,酸性增强,溶液的pH减小,B错;K=c(A-)·c(H+)/ c(HA)= 10-4×10-4/(0.1- 10-4)= 1×10-7 ,C正确;由HA电离出的c(H+)=10-4 mol/L,水电离出的c(H+)=10-10 mol/L ,因此D正确。
点评:本题综合程度较大,主要考查学生pH计算,电离平衡,影响弱电解质平衡的因素等相关知识。
17. (09重庆卷10)物质的量浓度相同的下列溶液,pH由大到小排列正确的是
A.Ba(OH)2、 Na2SO3、FeCl3、KCl
B.Na2SiO3、Na2SO3、KNO3、NH4Cl
C.NH3·H2O、H3PO4、Na2SO4、H2SO4
D.NaHCO3、C6H5COOH、C2H5OH、HCl
答案:B
解析:A项FeCl3是强酸弱碱盐溶液呈酸性,KCl是强碱强酸盐溶液呈中性,A错误;C项H3PO4显酸性,C错误;D项C2H5OH呈中性,C6H5COOH呈酸性,D错误;答案选B。
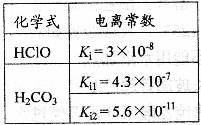
16.(09上海卷 17)根据右表提供的数据,判断在等浓度的
17)根据右表提供的数据,判断在等浓度的
 、
、 混合溶液中,各种离子浓度关系正确的是
混合溶液中,各种离子浓度关系正确的是
 A.
A.
 B.
B.
 C.
C.
 D.
D.
答案:A
[解析]由表中数据可知,H2CO3的酸性大于HClO,HClO的酸性大于HCO3-的酸性,则ClO-的水解程度大于HCO3-,故A项正确, B项错误。根据物料守恒和电荷守恒判断,C项和D项等式右边都漏掉了CO32-的浓度,故均错误。
15. (09四川卷12)关于浓度均为0.1 mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是
H+4):③>①
B.水电离出的c(H+):②>①
C.①和②等体积混合后的溶液:c(H+)=c(OH )+c(NH3·H2O)
)+c(NH3·H2O)
D.①和③等体积混合后的溶液:c(NH+4)>c(Cl )>c(OH
)>c(OH )>c(H+)
)>c(H+)
答案:B
 [解析]A项,氯化铵为强电解质完全电离后产生大量的NH4+;氨水为弱电解质只有少量的NH4+产生。B项在水中加入酸和碱都抑制水的电离,但是盐类水解促进水的电离,B项不正确。盐酸和氨水混合后恰好完全反应,但因生成的盐为强酸弱碱盐,溶液显酸性,而多余的H+为水解产生,C项正确。D项。①和③等体积混合,溶液呈碱性,即氨水的电离大于氯化铵的水解,这样不难得到D正确。
[解析]A项,氯化铵为强电解质完全电离后产生大量的NH4+;氨水为弱电解质只有少量的NH4+产生。B项在水中加入酸和碱都抑制水的电离,但是盐类水解促进水的电离,B项不正确。盐酸和氨水混合后恰好完全反应,但因生成的盐为强酸弱碱盐,溶液显酸性,而多余的H+为水解产生,C项正确。D项。①和③等体积混合,溶液呈碱性,即氨水的电离大于氯化铵的水解,这样不难得到D正确。
 [点评]
[点评] 本题综合考查弱电解质的电离、盐类的水解以及离子浓度大小比较等相关知识,对于考生的要求较高。
本题综合考查弱电解质的电离、盐类的水解以及离子浓度大小比较等相关知识,对于考生的要求较高。
14.(09北京卷11)有4种混合溶液,分别由等体积0.1mol/L的2种溶液混合面成:
① 与
与 ;②
;② 与
与
③ 与
与 ④
④ 与
与
下列各项排序正确的是
A.pH:②>③>④>①
B  :②>④>③>①
:②>④>③>①
C.溶液中:①>③>②>④
D  :①>④>③>②
:①>④>③>②
答案:B
 [解析]本题主要考查盐类水解知识的应用。①:CH3COONa与HCl反应后生成CH3COOH和NaCl,其溶液呈酸性。②:CH3COONa与NaOH溶液,OH―阻止CH3COO―水解,溶液呈强碱性。③:CH3COONNa与NaCl,CH3COONa水解溶液呈碱性。④:CH3COONa与NaHCO3溶液,NaHCO3水解呈碱性,HCO3―水解能力大于CH3COO―的水解能力,HCO3―水解对CH3COONa水解有一定抑制作用。选项A,④中的pH>③中pH,错误。选项B,②中由于OH―对CH3COO―水解抑制作用强,其c(CH3COO―)最大,④中HCO3―水解对CH3COONa水解有一定抑制作用,c(CH3COO―)较大,①中生成了CH3COOH,c(CH3COO―)最小,故正确。选项C,②中c(H+)最小,错误。选项D,③中c(CH3COOH)>④中c(CH3COOH),错误。
[解析]本题主要考查盐类水解知识的应用。①:CH3COONa与HCl反应后生成CH3COOH和NaCl,其溶液呈酸性。②:CH3COONa与NaOH溶液,OH―阻止CH3COO―水解,溶液呈强碱性。③:CH3COONNa与NaCl,CH3COONa水解溶液呈碱性。④:CH3COONa与NaHCO3溶液,NaHCO3水解呈碱性,HCO3―水解能力大于CH3COO―的水解能力,HCO3―水解对CH3COONa水解有一定抑制作用。选项A,④中的pH>③中pH,错误。选项B,②中由于OH―对CH3COO―水解抑制作用强,其c(CH3COO―)最大,④中HCO3―水解对CH3COONa水解有一定抑制作用,c(CH3COO―)较大,①中生成了CH3COOH,c(CH3COO―)最小,故正确。选项C,②中c(H+)最小,错误。选项D,③中c(CH3COOH)>④中c(CH3COOH),错误。
13.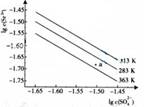 (09广东化学
(09广东化学 18)硫酸锶(SrSO4)在水中的深沉溶解平衡曲线如下。下列说法正确的是
18)硫酸锶(SrSO4)在水中的深沉溶解平衡曲线如下。下列说法正确的是
 A.温度一定时,Ksp(SrSO4)随
A.温度一定时,Ksp(SrSO4)随 的增大而减小
的增大而减小
 B.三个不同温度中,313K时Ksp(SrSO4)最大
B.三个不同温度中,313K时Ksp(SrSO4)最大
 C.283K时,图中a点对应的溶液是不饱和溶液
C.283K时,图中a点对应的溶液是不饱和溶液
 D.283K下的SrSO4饱和溶液升温到363K后变为不饱和溶液
D.283K下的SrSO4饱和溶液升温到363K后变为不饱和溶液

 答案:BC
答案:BC
 解析:Ksp只与温度有关,A错;
解析:Ksp只与温度有关,A错;
由图像可知:在相同条件下,温度越低, 越大,Ksp(SrSO4)越大,B正确;
越大,Ksp(SrSO4)越大,B正确;
a点在283K的下方,属于不饱和溶液,C正确;
283K下的SrSO4饱和溶液升温到363K后会有晶体析出,还是属于饱和溶液,D错。
12.
(09广东化学 9)下列浓度关系正确的是
9)下列浓度关系正确的是
 A. 氯水中:c(Cl2)=2[c(
A. 氯水中:c(Cl2)=2[c( )+c(
)+c( )+C(HClO)]
)+C(HClO)]
 B. 氯水中:c(
B. 氯水中:c( )>c(
)>c( )>c(
)>c( )>c(
)>c( )
)
 C. 等体积等浓度的氢氧化钠与醋酸混合:c(
C. 等体积等浓度的氢氧化钠与醋酸混合:c( )=c(
)=c( )
)
 D.
D.  溶液中:c
溶液中:c
 答案:D
答案:D
 解析:
解析:
 根据氯水中所含粒子的种类可知氯水中也含有氯气分子A设置了一个貌似物料守恒的式子而忽视了氯气分子的存在,故A错;
根据氯水中所含粒子的种类可知氯水中也含有氯气分子A设置了一个貌似物料守恒的式子而忽视了氯气分子的存在,故A错;
根据Cl2+H2O HClO+H++Cl-,HCl完全电离 而HClO部分电离,可知正确的顺序c(H+)>c(Cl-)>c(ClO-)>c(OH-),B错;
HClO+H++Cl-,HCl完全电离 而HClO部分电离,可知正确的顺序c(H+)>c(Cl-)>c(ClO-)>c(OH-),B错;
C项等物资的量的强碱与弱酸混合生成强碱弱酸盐溶液显碱性c( )>c(
)>c( ),再根据溶液中电荷守恒可以判断c(
),再根据溶液中电荷守恒可以判断c( )>c(
)>c( ;D项比较简单
;D项比较简单
11.(09福建卷 10) 在一定条件下,Na2CO3溶液存在水解平衡:
10) 在一定条件下,Na2CO3溶液存在水解平衡: 下列说法正确的是
下列说法正确的是
 A. 稀释溶液,水解平衡常数增大
A. 稀释溶液,水解平衡常数增大
B. 通入CO2,平衡朝正反应方向移动
C. 升高温度, 减小
减小 
D. 加入NaOH固体,溶液PH减小
答案:B
解析:平衡常数仅与温度有关,故稀释时是不变的,A项错;CO2通入水中,相当于生成H2CO3,可以与OH-反应,而促进平衡正向移动,B项正确;升温,促进水解,平衡正向移动,故表达式的结果是增大的,C项错;D项,加入NaOH,碱性肯定增强,pH增大,故错。
10.(09广东理科基础 33)下列说法正确的是
33)下列说法正确的是
 A.向0.1 mol/L Na2CO3溶液中滴加酚酞,溶液变红
A.向0.1 mol/L Na2CO3溶液中滴加酚酞,溶液变红
 B.Al3+、NO3- 、Cl-、CO32 -、Na+可大量共存于pH=2的溶液中
B.Al3+、NO3- 、Cl-、CO32 -、Na+可大量共存于pH=2的溶液中
 C.乙醇和乙酸都能溶于水,都是电解质
C.乙醇和乙酸都能溶于水,都是电解质
 D.分别与等物质的量的HCl和H2SO4反应时,消耗NaOH的物质的量相同
D.分别与等物质的量的HCl和H2SO4反应时,消耗NaOH的物质的量相同
 答案:A
答案:A
 解析:Na2CO3溶液水解显碱性,故加入酚酞是变红的,A项正确;pH=2为酸性溶液,所以CO32 -与H+是反应的,故不能共存,B项错;乙醇属于非电解质,C项错;硫酸为二元酸,故NaOH的物质的量是HCl的两倍,D项错。
解析:Na2CO3溶液水解显碱性,故加入酚酞是变红的,A项正确;pH=2为酸性溶液,所以CO32 -与H+是反应的,故不能共存,B项错;乙醇属于非电解质,C项错;硫酸为二元酸,故NaOH的物质的量是HCl的两倍,D项错。
9.(09浙江卷 10)已知:25°C时,
10)已知:25°C时, ,
, 。下列说法正确的是
。下列说法正确的是
 A.25°C时,饱和
A.25°C时,饱和 溶液与饱和
溶液与饱和 溶液相比,前者的
溶液相比,前者的 大
大
 B.25°C时,在
B.25°C时,在 的悬浊液加入少量的
的悬浊液加入少量的 固体,
固体, 增大
增大
 C.25°C时,
C.25°C时, 固体在20ml0.01 mol·
固体在20ml0.01 mol· 氨水中的
氨水中的 比在20mL0.01mol·
比在20mL0.01mol·
 溶液中的
溶液中的 小
小
 D.25°C时,在
D.25°C时,在 的悬浊液加入
的悬浊液加入 溶液后,
溶液后, 不可能转化成为
不可能转化成为
 答案:B
答案:B
 解析:
解析:
A项, Mg(OH)2的溶度积小,故其电离出的Mg2+浓度要小一些,错;
B项, NH4+ 可以结合Mg(OH)2电离出的OH-离子,从而促使Mg(OH)2的电离平衡正向移动,C(Mg2+)增大,正确。
C项, Ksp仅与温度有关,故错;
D项,由于MgF2的溶度积更小,所以沉淀会向更难溶的方向进行,即可以生成MgF2沉淀,正确。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com