
2、生成氢化物的稳定性:逐渐减弱.即氢化物稳定性次序为
HF>HCl>HBr>HI
反应通式:X2 + H2 === 2HX
[演示实验]卤素单质间的置换反应
|
|
|
|

 溶液由无色变成橙黄色
溶液由无色变成橙黄色
结论:氯可以把溴从其化合物中置换出来
[板书] (4) 卤素单质间的置换反应:2NaBr+ Cl2 = 2NaCl + Br2
|
|
|
|

 溶液由无色变成棕黄色
溶液由无色变成棕黄色
结论:氯可以把碘从其化合物中置换出来
[板书] 2NaI + Cl2 = 2NaCl + I2
|
|
|
|

 溶液由无色变成棕黄色
溶液由无色变成棕黄色
结论:溴可以把碘从其化合物中置换出来
[板书] 2NaI + Br2 = 2NaBr + I2
[讲]请同学们指出上述三个反应的氧化剂和氧化产物,得出氟氯溴碘的氧化性依次减弱的结论。
[板书] 随核电荷数的增加,卤素单质氧化性强弱顺序:
F2 Cl2 Br2 I2
 氧化性逐渐减弱
氧化性逐渐减弱
非金属性逐渐减弱
金属性逐渐增强
[思考与交流]主族元素随原子核外电子层数增加,它们得失电子能力、金属性、非金属性、递变的趋势。
[板书] (5) 非金属性强弱判断依据:
1、卤素单质与H2反应的剧烈程度:F2>Cl2>Br2>I2
1、根据金属单质与水或者与酸反应置换出氢的难易程度。置换出氢越容易,则金属性越强。
3.铷铯主要用于制备光电管、真空管。铯原子钟是目前最准确的计时仪器。
[板书]1、碱金属元素
[科学探究]1、查阅元素周期表中的有关信息,填写下表。
|
|
元素名称 |
核电荷数 |
原子结构示意图 |
最外层电子数 |
电子层数 |
|
碱 金 属 元 素 |
|
|
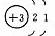 |
|
|
|
|
|
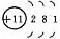 |
|
|
|
|
|
|
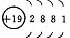 |
|
|
|
|
|
|
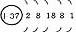 |
|
|
|
|
|
|
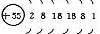 |
|
|
填写情况,总结异同点。
[板书](1) 在结构上:
结构异同:异:核电荷数:由小→大;
电子层数:由少→多;
同:最外层电子数均为1个。
最外层都有1个电子,化学性质相似;随着核电荷数的增加,原子的电子层数递增,原子核对最外层电子的引力逐渐减弱,金属性逐渐增强。
[讲]金属性:指气态原子失去电子的能力大小的性质(由电离能的大小确定)。还原性:指含有易失电子元素的物质的性质。具有还原性的不一定有金属性
[思考与交流]物质的性质主要取决于原子的最外层电子数,从碱金属原子的结构可推知其化学性质如何?是否完全相同?
 最外层上都只有一个电子,化学反应中易失去一个电子,形成+1价的阳离子,并能与氧气等非金属元素及水发生化学反应。
最外层上都只有一个电子,化学反应中易失去一个电子,形成+1价的阳离子,并能与氧气等非金属元素及水发生化学反应。
[探究实验]钾与氧气燃烧实验
[问]钾的保存及取用方法
煤油中;镊子夹取,玻璃片上小刀切割,滤纸吸干煤油。
演示实验,观察现象与钠与氧气反应对比,有何不同?
燃烧更剧烈,火焰紫色。
[讲]钾与氧气反应生成比过氧化物更为复杂的氧化物(超氧化物)
[投影]  (一个氧分子得1个电子)
(一个氧分子得1个电子)
(在这些氧化物中,氧元素的化合价不同)
[探究实验]钾与水反应实验
[学生分组实验]巡视并强调取用绿豆大小及吸干煤油(注意安全);请学生观察,与钠与水反应的现象作比较.

钾与水反应 钠与水反应
现象:钾比钠活泼,轻微爆炸.
[思考交流]钠与钾性质有什么相似性与不同?这与原子结构有什么关系?
[投影] 
[思考与交流]根据实验讨论钠与钾的性质有什么相似性和不同性。你认为元素的性质与他们的原子结构有关系吗?其余碱金属的性质又如何?
钠与钾都能与氧气、水发生反应,但反应的剧烈程度不同
[投影]视频演示Li、Rb、Cs与水反应的实验
[板书] (2) 碱金属元素在化学性质上的规律:
1 相似性:均能与氧气、与水反应,表现出金属性(还原性);
4Li + O2 ==== 2Li2O(白色、氧化锂)
2Na + O2 ==== Na2O2(淡黄色、过氧化钠)
2Na + 2H2O === 2NaOH + H2↑
2K + 2H2O === 2KOH + H2↑
2 递变性:与氧气、与水反应的剧烈程度有所不同;在同一族中,自上而下反应的剧烈程度逐渐增大;
[随堂练习]完成下列方程式:Rb与Cs与水反应的方程式
[投影]与氧气反应差异性:
 (橙黄色,超氧化钾)
(橙黄色,超氧化钾)
 (棕色、超氧化铷)
(棕色、超氧化铷)
 (红黄色、超氧化铯)
(红黄色、超氧化铯)
与水反应差异性: (剧烈燃烧、轻微爆炸)
(剧烈燃烧、轻微爆炸)
 (更猛烈、燃烧、爆炸)
(更猛烈、燃烧、爆炸)
[投影并小结]

[知识拓展]元素金属性判断标准:
[板书] (3) 元素金属性判断标准
2.钾的化合物最大用途是做钾肥。硝酸钾还用于做火药。
1.锂电池是一种高能电池。锂有机化学中重要的催化剂。锂制造氢弹不可缺少的材料。
锂是优质的高能燃料(已经用于宇宙飞船、人造卫星和超声速飞机)
5.1939年法国女科学家佩雷(M.Perey)在研究铀的天然放射系中发现该元素,为了纪念她的祖国而命名的“Francium”,意为“法兰西”。中文译为“钫”
碱金属的用途:
4.1861年基尔霍夫(Gustar Robert Kirchholf,
1824-1887)和本生发现了铷。
3.1860年本生(W.Bunsen,1811-1899)发现了铯。“铯”也是本生和基尔霍夫共同发现的。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com