
3、结构简式:CH3CH2OH或C2H5OH
1、分子式:C2H6O 2、结构式: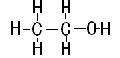
2、分别写出下列两种物质的结构简式
(1) 2,4-二甲基戊烷
(2) 2,2---二甲基---3---乙基庚烷
1、给下列有机物命名


1、习惯命名法
[讲]碳原子后边加一个烷字,就是简单的烷烃的名称,当碳原子数小球或等于10时,用甲-癸表示,当碳原子数大于10时,直接用字数表示,如十字烷。为了区别同分异构体,可以根据分子中支链数目的多少以“正”、“异”、“新”等来区别,
[过]那么,当一种烷烃分子的同分异构体数目较多时,如C7H16有9种同分异构体时,用习惯命名法该如何命名?
这说明习惯命名法对于分子里碳原子数很少,分子结构简单的烷烃分子还比较适用,而分子里碳原子数多,分子结构复杂的烷烃命名就显得力不从心了,这时候就得换一种命名方法,这种命名法叫系统命名法。
1982年,在日内瓦召开的国际化学会议上,拟定了有机物系统命名原则,叫做“日内瓦命名法”,它解决了命名的困难,使有机物的命名得到统一。我国一方面采用“日内瓦命名”原则,同时考虑我国文字的特点,制定了有机物的命名法。
[板书]2、系统命名法
[投影小结]烷烃的系统命名法可分为以下几步:
(1) 选定分子中最长的碳链为主链,且依主链碳原子的数目称之为“某烷”;
(2) 把主链中离支链最近的一端作为起点,用阿拉伯数字给主链上的各个碳原子依次编号定位,以确定支链的位置,如:
1 2 3 4

(3) 把支链作为取代基,把取代基的名称写出烷烃名称的前面,在取代基的前面用阿拉伯数字注明它在烷烃直链上所处的位置,并在数字与取代基名称之间用一短线隔开。例如,
 2--甲基丁烷
2--甲基丁烷
(4) 如果主链上有相同的取代基,可以将取代基合并起来,用二、三数字表示,在用于表示取代基位置的阿拉伯数字之间要用“,”隔开;如果主链上有几个不同的取代基,就用简单的写在前面,把复杂的写在后面,要尽可能使位号最小。
 2,3---二甲基己烷
2,3---二甲基己烷
 2-甲基---3---乙基己烷
2-甲基---3---乙基己烷
[板书]选主链,称某烷;编号码,定支链;取代基,写在前;注位置,连短线;不同基,简在前;相同基,二三连。
[讲]烷烃的系统命名法使用时要遵循两个基本原则:最简化原则和明确化原则,要表现在长、近、多,即“长”是主链最长,“近”是编号起点离支链最近,当两个相同支链离两端相等时,以离第三个支链最近的一端编号,“多”是指当最长的碳链有两条以上的,应选含支链最多的一条作为主链。
[讲]系统命名法不仅能通过命名来区别不同物质,更重要的是利用命名来力求反映出物质内部结构的特殊性和组成中的数量关系,同时,还可以从有机物名称了解物质的结构,从而可以初步推断物质的大致性质。
[知识拓展]判断同分异构体的重要方法------等效氢法(对称法)
[板书]等效氢判断方法如下:
(4) 同一个碳原子上的氢原子是等效的
(5) 同一个碳原子上所连甲基上的氢是等效的。
(6) 处于镜面对称位置上的氢原子是等效的。
[随堂练习]进行一氯取代反应后,只能生成三种沸点不同的产物的烷烃是( )
(A)(CH3)2CHCH2CH2CH3 (B)(CH3CH2)2CHCH3
(C)(CH3)2CHCH (CH3)2 (D)(CH3)3CCH2CH3
[小结]在学习了甲烷的主要性质和结构之后,再来讨论烷烃的性质和结构就类似于在元素及其化合物知识的学习中,通过由典型到一般的学习和讨论方法,这在有机物的学习中也是一种常见且很重要的方法。
[自我评价]
4、再从母链上取下3个碳原子,

[板书]成直链,一线串;取一碳,挂中间;向外排,不到端。
[讲]从母链上取上的碳原子数,不得多于母链所剩余的碳原子数,所以C7H16的同分异构体有9种,那么像烷烃分子同分异构体这样的同分异构现象,叫做碳链异构或碳架异构。当然,最后可以将这种碳原子骨架转变成对应的结构简式。
[过]前边我们把含有一个碳原子的两种烷烃分子分别叫甲烷、含有二个和三个碳原子的烷烃分子称为乙烷和丙烷,又把四个碳原子的两种烷烃分子分别叫正丁烷和异丁烷等,但七碳烷烃的各种同分异构体又该如何命名呢?下面就来讨论一下有关烷烃分子的命名
[板书]三、烷烃的命名
3、再从母链上一端取下两个C原子,这两个C原子相连或分开,依次连在母链所余下的各个碳原子上,得到多个带乙基或带两个甲基、主链比母链少2个碳原子的异构体骨架。




2、从母链的一端取下一个C原子,依次连接在母链中心对称线一侧的各个C原子上,即得到多个带有甲基、主链比母链少一个碳原子的异构骨架:

但应注意的是取代基不能连在末端,否则与原直链时相同。
1、 将分子中全部碳原子连成直链做母链

4、能说明甲烷的分子不是平面正方形,而是正四面体的是 ( AD )
A、CH4分子中的键长、键角都相等
B、CH4与氯气能生成 4 种取代产物
C、CH4的一氯代物只有一种
D、CH4的二氯代物只有一种
教 案
|
课题:第三章 有机化合物 第一节 最简单的有机化合物------甲烷 (2)------烷烃 |
授课班级 |
|
|||||||||||||||||||||||
|
课 时 |
2 |
||||||||||||||||||||||||
|
教 学 目 的 |
知识 与 技能 |
1、掌握烷烃的分子组成、结构等的特征。 2、理解同系物、烃基等概念,学会烷烃的命名。 3、理解同分异构体概念。 4、了解烷烃系列的性质变化规律。 |
|||||||||||||||||||||||
|
过程 与 方法 |
1、基本学会烷烃同分异构体的分析方法,能够书写5个碳原子以下烷烃的同分异构体结构简式。 2、从甲烷的性质推导到烷烃的性质的过程中,学会从一种代表物质入手掌握同系列有机物性质的方法。 |
||||||||||||||||||||||||
|
情感 态度 价值观 |
通过实践活动、探究实验和多媒体动画等,培养学生关心科学、研究科学和探索科学的精神,激发学生学习化学的兴趣,探索新知识的欲望。 |
||||||||||||||||||||||||
|
重 点 |
烷烃的性质和同分异构体概念的学习 |
||||||||||||||||||||||||
|
难 点 |
烷烃的性质和同分异构体概念的学习 |
||||||||||||||||||||||||
|
知 识 结 构 与 板 书 设 计 |
一、烷烃(alkane)的结构和性质 1、烷烃的定义: 碳原子之间只以单键相结合,剩余的价键均与氢原子结合,使每个碳原子的化合价都达到“饱和”,像这样的烃叫做“饱和烃 ( saturated hydrocarbon ) ”,也称为烷烃。 2、烷烃的结构式和结构简式 3、烷烃的通式:CnH2n+2 (n≥1) 4、物理性质 (1) 随着分子里含碳原子数的增加,熔点、沸点逐渐升高,相对密度逐渐增大, (2) 分子里碳原子数等于或小于4的烷烃在常温常压下都是气体,其他烷烃在常温常压下都是液体或固体。 (3) 烷烃的相对密度都小于水的密度 5、化学性质 (1) 烷烃化学性质比较稳定,常温下不和强酸、强碱、强氧化剂等反应,不能使KMnO4酸性溶液和溴水褪色。 (2) 烷烃的可燃性 CnH2n+2 +  O2 O2 n CO2
+ (n+1) H2O n CO2
+ (n+1) H2O(3) 光照下和卤素单质发生取代反应 二、同系物(homolog) 1、定义: 结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物。 2、特点: (1) 同系物属于同一类物质,且有相同的通式。 (2) 式量相差一定是14的倍数。 (3) 同系物的化学性质相似,物理性质随着碳原子数的增加而发生规律性的变化 三、同分异构现象( isomerism)和同分异构体(isomer) 1、定义: 具有相同的分子式,但具有不同结构的现象称为同分异构现象 具有同分异构现象的化合物互称为同分异构体。 2、特点: (1) 分子式相同,即化学组成和相对分子质量相同 (2) 可以是同类物质,也可以是不同类物质 (3) 同分异构现象是产生有机物种类繁多的重要原因之一 (4) 产生同分异构的原因:碳链异构、官能团异构、空间异构 3、同分异构体间的物理性质变化规律: 碳原子数相同,支链越多,熔沸点越低 4、烃基: 烃分子失去一个或几个氢原子所剩余的部分叫烃基,用“R-”表示。 5、烷烃同分异构体的书写 成直链,一线串;取一碳,挂中间;向外排,不到端。 三、烷烃的命名 1、习惯命名法 2、系统命名法: 选主链,称某烷;编号码,定支链;取代基,写在前;注位置,连短线;不同基,简在前;相同基,二三连。 等效氢判断方法如下: (1) 同一个碳原子上的氢原子是等效的 (2) 同一个碳原子上所连甲基上的氢是等效的。 (3) 处于镜面对称位置上的氢原子是等效的。 |
||||||||||||||||||||||||
|
教学过程 |
|||||||||||||||||||||||||
|
教学步骤、内容 |
教学方法、手段、师生活动 |
||||||||||||||||||||||||
|
[知识回顾]甲烷的分子结构有什么特点? 甲烷分子是以碳原子为中心的、四个氢原子为顶点的正四面体型的立体结构,是典型的非极性分子 [问]甲烷有哪些主要化学性质? 甲烷的主要化学性质表现在:通常情况下,甲烷对强酸、强碱和强氧化剂稳定;可与氧气在点燃条件下发生氧化反应,生成二氧化碳和水;可与氯气等卤素在光照条件下发生取代反应,并生成多种取代产物;在无氧高温的条件下,甲烷可以发生分解反应,生成炭黑和氢气。 [问]什么叫取代反应? 有机物分子里的某原子或原子团被其他原子或原子团所代替的反应叫做取代反应。 [引入]甲烷是最简单的烃,在烃里边还有许多结构和性质怀与甲烷相似的分子,如乙烷、丙烷等等,这就是我们这节课的主题------烷烃。首先,让我们先来了解一下烷烃的结构和性质。 [板书]一、烷烃(alkane)的结构和性质 [探究活动]给每个学习小组分发一些小球和小棍,自己动手来制作甲烷、乙烷、丙烷和丁烷的球棍模型。在制作时大家要注意检查碳原子的四个价键是否已被充分利用。 可参照教材P62 “图3-4 几种烷烃的球棍模型”边讨论边制作,分别得到四种分子模型。 [投影]几种烷烃的球棍模型  [问]大家细心地观察你们撑竿跳所制得的各种模型,看看碳原子与碳原子的连接方式有何特点?碳原子周围总共形成了几个化学键? 在这些烃的分子里,碳原子跟碳原子都以单键结合成链状,像甲烷一样,碳原子的剩余的价键全部跟氢原子相结合,总共形成了四个化学键。 [讲]这样的结合使得每个碳原子的化合价都已充分利用,都达到饱和,我们把这种烃叫“饱和烃”,又叫“烷烃”。 [板书]1、烷烃的定义:碳原子之间只以单键相结合,剩余的价键均与氢原子结合,使每个碳原子的化合价都达到“饱和”,像这样的烃叫做“饱和烃(saturated hydrocarbon)”,也称为烷烃。 [讲]由于C-C连成链状,所以又叫饱和链烃, [板书]2、烷烃的结构式和结构简式 [问]请同学们根据你们所制的各种分子的模型写出乙烷、丙烷和丁烷的结构式  乙烷 丙烷 丁烷 [讲]书写结构式时要注意,我们通常是将其写成直线形式,但同一个碳上连接的四个价键的位置是可以互相调换,因为在空间内四个价键是可以旋转的。例如,下列各物质结构式虽貌似不同,但却是同一物质。 [投影] 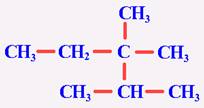 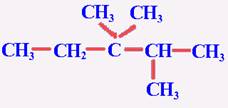  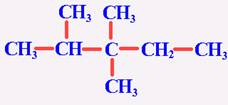 [问]若把上述各分子的结构式中表示共价单键的“---”删去,会变成什么样子? 乙烷 CH3CH3 丙烷 CH3CH2CH3 丁烷 CH3CH2CH2CH3 [讲]变形后的式子书写起来是比较方便的,我们称之为有机物的结构简式。当然,在书写有机物的分子的结构简式时,若遇到像丁烷分子中有两个或多个相同的成分时,还可以写成CH3(CH2)2CH3。由于结构简式书写方便,且仍能表示出分子结构的简况,所以更多情况下常使用结构简式。 [讲]由甲烷、乙烷、丙烷的分子式分别为CH4、C2H6、C3H8,可以推出含n个碳原子的烷烃的通式:CnH2n+2 (n≥1)。但要注意的是,通式中n值从理论上说是自然数,但现实中n值并不是无限大,再则,此通式为开式链烃的通式。 [板书]3、烷烃的通式:CnH2n+2 (n≥1) [过]既然甲烷的结构和其它烷烃分子很相似,那么它们在性质上是否也很相似呢? [板书]4、物理性质 [投影]几种烷烃的物理性质 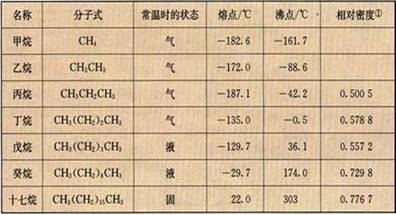  [学生活动]思考、分析表中的数据,讨论,并得出一些规律。 [板书](1) 随着分子里含碳原子数的增加,熔点、沸点逐渐升高,相对密度逐渐增大, (2) 分子里碳原子数等于或小于4的烷烃在常温常压下都是气体,其他烷烃在常温常压下都是液体或固体。 (3) 烷烃的相对密度都小于水的密度 [问]造成烷烃熔沸点随碳原子数增多而升高的原因是什么呢? 组成和结构相似,相对分子量越大,分子间作用力越大,熔沸点越高。 [讲]在这里我们要注意的是:  1、表中所列烷烃均为无支链的烷烃,亦即分子组成与结构都相似的烷烃,而且碳原子数增多的过程也是相对分子质量增加的过程。 1、表中所列烷烃均为无支链的烷烃,亦即分子组成与结构都相似的烷烃,而且碳原子数增多的过程也是相对分子质量增加的过程。2、常温常压下是气体的烷烃除了上述碳原子数小于或等于4的几中分子外,还有一种碳原子数为5的分子---分子中含有支链的戊烷: 3、烷烃分子一般不溶于水,而易溶于有机溶剂,液态烷烃本身就是很好的有机溶剂。 [过]甲烷与其他烷烃结构的相似不仅表现在物理性质上的规律性变化,而且化学性质也具有极大的相似性,请同学们根据甲烷的化学性质总结、推测烷烃应有的化学性质 [板书]5、化学性质 (1) 烷烃化学性质比较稳定,常温下不和强酸、强碱、强氧化剂等反应,不能使KMnO4酸性溶液和溴水褪色。 [讲]烷烃都由碳氢两种元素组成,由空气或氧气中可以燃烧,表现为可燃性。 [板书](2) 烷烃的可燃性 [讲]我们知道了烷烃的通式,那么能否写出烷烃燃烧的通式呢? [板书]CnH2n+2 +  O2 O2 n CO2
+ (n+1) H2O n CO2
+ (n+1) H2O [讲]甲烷可以发生卤代反应,其他烷烃一样可以发生取代反应。 [板书](3) 光照下和卤素单质发生取代反应 [讲]大家再比较一下相邻碳原子数的烷烃在分子组成上有何特点,当然也可以用通式来推算。 在分子组成上差一个或若干个CH2原子团 [讲]类似烷烃各分子这样,分子结构相似,在分子组成上相关一个或若干个CH2原子团的物质,互称为同系物。 [板书]二、同系物(homolog) 1、定义:结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物。 [点击试题]下列各组内的物质不属于同系物的是( c ) A、  B、  C、  D、  [讲]在判断同系物的时候,要严格把握同系物概念涵义的两个方面:一是分子结构相似,二是分子组成上相差一个或若干个CH2原子团,二者要联系在一起应用,缺一不可。当然,还应注意,同系物的关系不光是只有烷烃分子之间存在,在其他的有机物内也存在着同系物的关系。 请同学们自己小结一下同系物的特点 [板书]2、特点: (1) 同系物属于同一类物质,且有相同的通式。 (2) 式量相差一定是14的倍数。 (3) 同系物的化学性质相似,物理性质随着碳原子数的增加而发生规律性的变化 [过]现在给每个学习小组发一些小球,(黑色稍大球代表碳原子,红色稍小球代表氢原子)和小棍,要求按照烷烃分子的结构特点,来制作含有五个碳原子的烷烃分子的可能结构的球棍模型,并根据自己所制作的模型写出对应的结构式和分子式,看看哪组又快又好。 [学生活动]以小组为单位进行讨论和制作,综合各组结果得到三种结构,并初步认识到它们的结构虽然不同,但分子组成即分子式是相同的。 [投影] 
   [讲]从大家的制作结果可以看出含有五个碳原子的烷烃分子尽管分子式相同,均为C5H12,但它们的结构是完全不一样的,这一现象在有机化合物中非学普遍。我们称之为同分异构现象,具有相同分子式但结构不同的化合物之间互称为同分异构体。 [板书]三、同分异构现象( isomerism)和同分异构体(isomer) 1、定义:具有相同的分子式,但具有不同结构的现象称为同分异构现象 具有同分异构现象的化合物互称为同分异构体。 [讲]大家在理解同分异构体现象和同分异构体概念时应注意两点:一是分子式相同。分子同必然相对分子质量相同,但相对分子质量相同分子式不一定相同。二是分子结构不同。分子结构不同是分子里原子或原子团的排列方式不同而引起的。 [板书]2、特点: (1) 分子式相同,即化学组成和相对分子质量相同 (2) 可以是同类物质,也可以是不同类物质 (3) 同分异构现象是产生有机物种类繁多的重要原因之一 (4) 产生同分异构的原因:碳链异构、官能团异构、空间异构 [讲]同分异构体的分子虽然相同,但结构不同,而物质的结构决定物质的性质,所以它们的性质不同。如丁烷,存在两种同分异构体,一种是分子里的碳原子互相结合成直链,被称为正丁烷,另一种分子里的碳原子却带有支链被称为异丁烷,它们的性质就有明显的差异。 [投影]正丁烷结构和物理性质比较   [问]根据表中的数据分析同分异构体之间的熔沸点、相对密度有何变化规律? 从表中的数据可以看出异丁烷的熔沸点、相对密度均比正丁烷的低。 [问]两种分子结构上有什么差异? 异丁烷有支链,而正丁烷是直链。 [讲]我们可由此概括出一结论,即在其他条件相同时,各同分异构体当中分子里数越多,该分子的熔沸点越低,相对密度越小。 [板书]3、同分异构体间的物理性质的变化规律: 碳原子数相同,支链越多,熔沸点越低 [问]为什么会出现这种情况呢? [讲]原因是支链越多,分子间排列不紧密,分子间作用力越弱。 [投影小结]四同比较
[问]如果在烷烃分子的结构中推动一个或几个氢原子,剩余部分名称是什么呢? [板书]4、烃基:烃分子失去一个或几个氢原子所剩余的部分叫烃基,用“R-”表示。 [讲]如果该烃是烷烃所形成的烃基便称之为烷基,如-CH3 叫甲基。由于同分异构现象,那么当碳原子较多时,烃基也存在异构体。如丙基就有两种现象: [问]如何完整地写出一种碳原子数较多的烷烃分子的所有同分异构体(如C7H16)? [板书]5、烷烃同分异构体的书写 [讲]在书写烷烃分子的同分异构体时一方面为了简便起见,可以先不写出氢原子,只用碳原子的不同关系来表示,因为同分异构体的形成是由于碳原子的位置或排列变化而引起的。书写技巧如下: [投影]C7H16同分异构体的书写步骤 同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |