
1.(07年宁夏理综·11)下列反应的离子方程式正确的是
A.锌片插入硝酸银溶液中:Zn+Ag+=Zn2++Ag
B.碳酸氢钙溶液加到醋酸中:Ca(HCO3)2+2CH3COOH=Ca2++2CH3COO-+2CO2↑+2H2O
C.少量金属钠加到冷水中:Na+2H2O=Na++OH-+H2↑
D.氢氧化铜加到盐酸中:Cu(OH)2+2H+=Cu2++2H2O
答案:D
解析:A选中的例子方程式电荷不守恒,正确的例子方程式应为Zn+2Ag+=Zn2++2Ag;B选项中的Ca(HCO3)2为可溶性盐,应写为离子符号,正确的离子方程式应为HCO3-+CH3COOH=+CH3COO-+CO2↑+H2O;C选项中的离子方程式质量不守恒,正确的离子方程式应为2Na+2H2O=2Na++2OH-+H2↑;D选项中的离子方程式符合书写要求,是正确的。
1.(07年山东理综·12)下列叙述正确的是
A.16 8O2和18 8O2互为同位素,性质相似
B.常温下,pH=1的水溶液中Na+、NO3-、HCO3-、Fe2+可以大量共存
C.明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同
D.C(石墨,s)=C(金刚石,s) △H>0,所以石墨比金刚石稳定
答案:D
解析:A选项中同位素是指中子数不同、质子数相同的不同核素(原子)的互称,选项中给出的是分子,错误;B中PH=1的溶液为强酸性环境,解答时应在离子组Na+、NO3-、HCO3-、Fe2+ 中增加H+,分析可知碳酸氢根离子和氢离子不共存,在氢离子存在时硝酸根离子和亚铁离子不能共存,错误;C中明矾的净水原理是其溶于水电离产生的铝离子水解生成氢氧化铝能吸附水中悬浮物,而漂白粉是由其成分中的次氯酸钙和水、二氧化碳反应生成的次氯酸能杀菌消毒,作用原理不同,错误;D中此反应的△H>0,说明此反应是吸热反应,也就是金刚石的具有能量大于石墨,物质具有的能量越大,该物质越不稳定,正确。
2.海洋占地球表面积的3/4,它能对地球生态环境起调节作用,同时也蕴藏着丰富的物质资源。
(1)据测算,地球上的氧气90%来自于藻类植物的光合作用,而环境污染的加剧,使海洋表层的浮游植物大量死亡,从而进一步加剧温室效应,这是由于大量浮游植物的死亡会使大气中的 增加所致。
(2)我国首创的铝、空气、海水电池为能源的新型海水标志灯已研制成功。这种灯以海水为电解质,靠空气中的氧使铝不断氧化而产生电流。上述新型电池 为负极。 2、(1)CO2 (2)Al
6、科学工作者为心脏病人设计的心脏起搏器的电池是以Pt和Zn为电极材料,依靠人体内液体中含有一定浓度的溶解氧、H+和Zn2+进行工作,回答下列问题
(1)负极材料是______ 电极反应式是____________________
(2)正极材料是______ 电极反应式是___________________
[课后作业]案例分析:在伦敦的上流社会,有一位贵族夫人格林太太,幼年时因蛀牙补过一颗不锈钢的假牙。不料后来,她又因为车祸掉了一颗牙,为了显示其富有,她装了一颗黄金假牙。自此以后,她就经常出现头痛、失眠心情烦燥等症状。更奇怪的是,众多的医学家为她检查后,都找不到病因是什么。这位夫人整日感到精神萎靡,找遍各大医院会诊也不见效果。格林太太的病因到底是什么呢?请同学根据本节的知识和我们生物学上的常识进行一下诊断。
教 案
|
课题:第二章 第二节 化学能与电能(二) |
授课班级 |
|
||||
|
课 时 |
|
|||||
|
教 学 目 的 |
知识 与 技能 |
在获得原电池概念和组成条件的基础上,能设计出一些原电池实验,学习实验研究的方法 |
||||
|
过程 与 方法 |
1、 在探究设计原电池实验的过程中,学会运用观察、实验、查阅资料等多种手段获取信息,并运用比较、分类、归纳、概括等方法对信息进行加工 2、 能对自己的化学学习过程进行计划、反思、评价和调控,提高自主学习化学的能力 |
|||||
|
情感 态度 价值观 |
1、有参与化学科技活动的热情,有将原电池知识应用于生产、生活实践的意识,能够对与化学有关的社会和生活问题作出合理的判断 2、了解原电池对个人生活和社会发展的贡献,关注能源问题,逐步形成可持续发展的思想 |
|||||
|
重 点 |
在实验探究的基础上认识原电池的组成及应用 |
|||||
|
难 点 |
对研究成果以及学习过程和结果的评价和反思 |
|||||
|
知 识 结 构 与 板 书 设 计 |
知识拓展------原电池的应用 ①制作化学电源 ②加快反应速率: ③判断金属活动性的强弱 ④揭示钢铁腐蚀的原因及防止钢铁的腐蚀。 二、发展中的化学电源(chemical power source) 1.干电池( dry cell) 负极(锌筒):Zn -2e-= Zn2+; 正极(石墨):正极:2NH4++2e-=2NH3+H2 电池的总反应式为:Zn +2NH4+= Zn2++ 2NH3+H2 副反应:副反应:H2+2MnO2=Mn2O3+H2O 4NH3+Zn2+=[Zn(NH3)4]2+ 2、充电电池 (1) 铅蓄电池(storage battery) 负极:Pb-2e-+SO42-=PbSO4 正极:PbO2+2e-+4H++SO42-=PbSO4+2H2O 蓄电池充电和放电的总化学方程式为:Pb+PbO2+2H2SO4 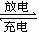 2PbSO4+2H2O 2PbSO4+2H2O(2)镍氢电池 负极:H2 +2OH- -2e-= 2H2O 正极:2NiO(OH) +2H2O +2e- = 2Ni(OH)2 +2OH- 放电总反应式:H2 + 2NiO(OH) = 2Ni(OH)2 (3)碱性蓄电池 1银锌电池: 负极:Zn+2OH--2e-=ZnO+H2O 正极:Ag2O+H2O+2e-=2Ag+2OH- 银锌电池充电和放电的总化学方程式为:Zn+Ag2O+H2O 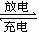 2Ag+Zn(OH)2 2Ag+Zn(OH)22 镉镍电池: 负极:Cd+2OH--2e-=Cd(OH)2 正极:2NiO(OH)+2e-+2H2O=2Ni(OH)2+2OH- 镉镍电池充电和放电的总化学方程式为: 2NiO(OH)+Cd+2H2O 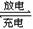 2Ni(OH)2+Cd(OH)2 2Ni(OH)2+Cd(OH)2(4) 锂电池 负极:Li - e- = Li+ 正极:MnO2 + e- = MnO2- 总反应式:Li + MnO2 = LiMnO2 3.燃料电池(fuel cell) (1) 氢氧燃料电池 (碱性)电极反应:负极:2H2+4OH--2e-=4H2O 正极:O2+2H2O+2e-=4OH- 电池的总反应为:2H2 + O2 = 2H2O 若电解质溶液为稀H2SO4 负极:2H2 -4e-=4H+ 正极:O2+ 4H+ + 4e-= 2H2O 放电总反应式: 2H2 + O2 = 2H2O (2) 甲烷氧气燃料电池 负极:CH4+10OH--8e-=CO32-+7H2O 正极:2O2+4H2O+8e-=8OH- 电池的总反应式为:CH4+2O2+2KOH=K2CO3+3H2O |
|||||
|
教学过程 |
||||||
|
教学步骤、内容 |
教学方法、手段、师生活动 |
|||||
|
[知识回顾]1、原电池的原理 2、简单的原电池的正负极和电子流向如何? [过]上节课我们重点学习了原电池的原理和构成条件,那么原电池的原理又是如何应用在我们的生产生活领域上的呢? [板书]知识拓展------原电池的应用 ①制作化学电源 ②加快反应速率: [讲]例如,实验室制H2 时,由于锌太纯,反应一般较慢,可加入少量CuSO4以加快反应速率。 [板书]③判断金属活动性的强弱 ④揭示钢铁腐蚀的原因及防止钢铁的腐蚀。 [讲]钢铁中含有碳,可与Fe组成原电池,发生原电池反应而使钢铁遭到腐蚀 [讲]有一位非常喜欢赶时髦的富商决定建造一艘海上游艇,为了使游艇奢侈豪华,他不惜重金让造船师用昂贵、漂亮、对海水有很强抗腐蚀能力的镍铜合金将船底包起来,由于这种合金的金属强度不够大,造船师又不得不用特种钢来制造游艇的许多零件。在一片赞美声中,游艇缓缓驶进了大海,畅游于碧海波涛中。可是未过几周,这艘游艇底部变得千疮百孔,过早结束了它的使命。你能解释其中的原因吗?  [引言]人们应用原电池原理,制作了多种电池,如干电池、蓄电池、充电电池、高能电池等,以满足不同需要。我们课我们具体来学习几种利用化学能转变为电能的化学电源。 [板书] 二、发展中的化学电源(chemical power source) [讲]最古老的电池 -- 巴格达电池 1936年6月,伊拉克考古学家在巴格达城郊,发现了大量公元前二百多年属于波斯王朝时代的文物,其中包括一些奇怪的陶制器皿和生锈的铜管、铁棒。陶制器皿有点像花瓶,高15厘米,呈淡黄色,瓶里装满了沥青,沥青之中有个铀管,直径2.6厘米,高9厘米,铀管中又有一层沥青,并有一根锈迹斑斑的铁棒。 [讲]上述原电池的结构较简单,携带也不方便,当今的电池工业已能制造出各种各样的实用电池。实用电池一般应具有的特点是:能产生稳定而具有较高电压的电流:安全、耐用且便于携带;能够适用于特殊用途;便于回收处理,不污染环境或对环境产生较小的影响,下面我们来简单介绍几种常见电池和新型电池。 [板书] 1.干电池( dry cell) [讲]干电池是用锌制圆筒型外壳作负极,位于中央的顶盖有铜的石墨作正极,在石墨周围填充NH4Cl和淀粉糊作电解质,还填有MnO2和炭黑(Zn-Mn电池) [板书]负极(锌筒):Zn -2e-= Zn2+; 正极(石墨):正极:2NH4++2e-=2NH3+H2 电池的总反应式为:Zn +2NH4+= Zn2++ 2NH3+H2 副反应:副反应:H2+2MnO2=Mn2O3+H2O 4NH3+Zn2+=[Zn(NH3)4]2+ [讲]淀粉糊的作用是提高阴、阳离子在两极的析出速率。ZnCl2的作用是吸收NH3。MnO2作用是吸收正极放出的H2生成MnO(OH) ,从而消除电极正极H2的集结现象,防止产生极化。干电池是一次性电池,放电后不能再使用,内部氧化还原反应不可逆。为提高使用寿命,用KOH代替NH4Cl来提高性能。 干电池的主要用途是录音机、闪光灯、手电筒、电动玩具、袖珍电视机以及电极、空调摇控器等。 [过]充电电池又称二次电池 。可充电电池是两极都参加反应的电池。这是一种发展较快的原电池,如铅蓄电池、银锌电池、(纽扣电池)、锂电池、爱迪生蓄电池等,它们的负极是较活泼的金属,正极一般是金属氧化物。放电时,负极被氧化。正极材料的氧化物被还原,充电时的电极反应与放电时相反。 [板书]2、充电电池 (1) 铅蓄电池(storage battery) [讲]铅蓄电池可放电亦可充电,它是用硬橡胶和透明塑料制成长方形外壳,在正极板上有一层棕褐色的PbO2,负极是海棉状的金属铅,两极均浸入硫酸溶液中,且两极间用橡胶或微孔塑料隔开。 [板书]负极:Pb-2e-+SO42-=PbSO4 正极:PbO2+2e-+4H++SO42-=PbSO4+2H2O 蓄电池充电和放电的总化学方程式为: Pb+PbO2+2H2SO4 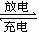 2PbSO4+2H2O 2PbSO4+2H2O[讲]当放电进行到硫酸的浓度降低,溶液的密度达到1.18g/cm3时应停止使用,需充电,充电时起电解池的作用。 [思考与交流]铅蓄电池在放电前后电解质溶液和电极分别有哪些变化?这对电池的继续工作会带来哪些影响? 电解质溶液的浓度有所下降,同时电极上都附着一层难溶物PbSO4 使电池的电压降低,电压不稳定,欲使其恢复,就要对其进行充电 [板书](2)镍氢电池 负极:H2 +2OH- -2e-= 2H2O 正极:2NiO(OH) +2H2O +2e- = 2Ni(OH)2 +2OH- 放电总反应式:H2 + 2NiO(OH) = 2Ni(OH)2 [讲]1970-1975开发了先进的银锌、镍镉电池技术。1975-1983美国海军生产潜水艇用银锌电池。1979-1987美国国家能源部发展电动车用的镍锌电池。1998-1992美国海军发展世界上最大的镍镉电池用于核潜水 [板书](3)碱性蓄电池 1银锌电池: 负极:Zn+2OH--2e-=ZnO+H2O 正极:Ag2O+H2O+2e-=2Ag+2OH- 银锌电池充电和放电的总化学方程式为: Zn+Ag2O+H2O 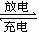 2Ag+Zn(OH)2 2Ag+Zn(OH)2[讲]正极壳填充Ag2O和石墨,负极盖填充锌汞合金,电解质溶液KOH。 [板书] 2 镉镍电池: 负极:Cd+2OH--2e-=Cd(OH)2 正极:2NiO(OH)+2e-+2H2O=2Ni(OH)2+2OH- 镉镍电池充电和放电的总化学方程式为: 2NiO(OH)+Cd+2H2O 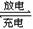 2Ni(OH)2+Cd(OH)2 2Ni(OH)2+Cd(OH)2[讲] [讲解]负极材料:Cd,正极材料:涂有NiO2,电解质:KOH溶液。镍镉电池寿命较蓄电池长,但镉是致癌物,镍镉污染环境。 [讲]还有一种广泛用于笔记本电脑、移动电话、摄像机的锂离子电池,其寿命较长,被称为绿色电池 [板书](4) 锂电池 负极:Li - e- = Li+ 正极:MnO2 + e- = MnO2- 总反应式:Li + MnO2 = LiMnO2 [讲]优点:质量轻、容量大、放电时间长。锂电池是一种高能电池,锂作为负极,技术含量高,有质量轻、体积小、电压高、工作效率高和寿命长等优点。常用于电脑笔记本、手机、照相机、心脏起博器、火箭、导弹等的动力电源。 [讲]还有一种新型高效氢氧燃料电池,主要用于航天领域,它的电极一般为活化电极,具有很强的催化活性,如铂电极、活性炭电极等,电解质溶液为40%KOH溶液。 [板书]3.燃料电池(fuel cell) (1) 氢氧燃料电池 (碱性)电极反应:负极:2H2+4OH--2e-=4H2O 正极:O2+2H2O+2e-=4OH- 电池的总反应为:2H2 + O2 = 2H2O [讲]该电池的特点是能量转化率高,可达70%以上,且其燃烧的产物为水,因此不污染环境。 [板书] 若电解质溶液为稀H2SO4 负极:2H2 -4e-=4H+ 正极:O2+ 4H+ + 4e-= 2H2O 放电总反应式: 2H2 + O2 = 2H2O [讲]新型燃料电池:该电池用金属铂片插入KOH溶液中作电极,又在两极上分别通甲烷和氧气。 [板书](2) 甲烷氧气燃料电池 负极:CH4+10OH--8e-=CO32-+7H2O 正极:2O2+4H2O+8e-=8OH- 电池的总反应式为:CH4+2O2+2KOH=K2CO3+3H2O |
|
|||||
|
教学回顾: |
||||||
5.一个电池反应的离子方程式是 Zn+Cu2+=Zn2+ +Cu,该反应的的原电池正确组合是( )
题型5 原电池电极反应的书写

4.把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为( )
A.a > b > c > d B.a > c > d > b
C.c > a > b .> d D.b > d > c > a
题型4 原电池的构成条件
3.由铜锌和稀硫酸组成的原电池工作时,电解质溶液的 PH( )
A.不变 B先变大后变小
C逐渐变大 D.逐渐变小
题型3 利用原电池电极判断金属性强弱
2.某金属能跟稀盐酸作用发出氢气,该金属与锌组成原电池时,锌为负极,此金属是( )
A.Mg B.Fe C.Al D.Cu
4、 写电极反应时要遵守守恒原则,可在电极反应式一端据需要添加H+或OH―或H2O,将两个电极反应式合起来,即可得到电池反应总方程式。
[点击试题]

[讲]通过以上的讨论,我们也可以抽象出原电池化学反应的本质是较活泼的金属发生氧化反应,电子从较活泼的金属(负极)通过外电路流向较不活泼的金属(正极)
[板书]2、原电池反应的本质:氧化还原反应且是能自发进行的反应(一般是放热的)
[讲]上面,我们通过实验探究了解了原电池的工作原理,初步形成原电池的概念,那么,原电池是由哪些部分组成的?也即原电池的构成条件是什么?
[科学探究]
探究目标:根据已有的氧化还原反应知识和电学知识,利用提供的实验用品,设计一套原电池装置,探究原电池的构成条件
实验1、如果两极的材料组成相同和不同时,将会产生什么现象?

实验2 如果溶液的导电性强弱不同时,将会产生什么现象?

实验3 如果两个电极在同一容器和不同容器中将会产生什么现象?

学生分组总结汇报实验结果和实验结论,师生共同交流探讨,得出结论
[板书]3.构成原电池的条件
⑴有两种活动性不同的金属(或一种是非金属导体如碳棒)做电极。
负极:较活泼的金属
正极:较不活泼的金属或非金属导体
⑵电极材料均插入电解质溶液中。
⑶两电极要相连接或接触,形成闭合回路。
⑷自发进行的氧化还原反应。
[讲]在这里我们要注意的是,原电池中,负极的金属性比正极强。电极可能与电解质反应,也可能与电解质不反应。形成闭合回路的方式有多种,可以是导线连接两个电极,也可以是两电极接触。有的原电池产生的电流大,可以对外做功;有的原电池,电极上发生的反应很慢,产生的电流极其微弱,不能对外做功
[讲]最后,我们总结一下原电池正负极的判断方法
[板书]4、原电池正负极的判断方法
(1) 由组成原电池的两极材料判断:一般是活泼的金属为负极;活泼性较弱的金属或能导电的非金属为正极
(2) 根据电流方向或电子流动方向判断:电流是由正极流向负极;电子流动方向是由负极流向正极
(3) 根据原电池两极发生的变化来判断:失电子的反应→氧化反应→负极;得电子的反应→还原反应→正极
[讲]除此之外,还可根据原电池里电解质溶液内离子的定向流动方向来判断:在原电池的电解质溶液内,阳离子的移向的极是正极,阴离子移向的极是负极。
还有,若原电池工作后,X极质量增加,说明溶液中的阳离子在X极(正极)放电,X级活动性较弱。
若原电池工作后,X极上有气泡冒出,是因为发生了析出H2的电极反应,说明X极为正极,活动性弱。
即增重或产生气泡的为正极,溶解的为负极。
但有些特殊情况要考虑电极与电解质溶液的反应,例如,Mg、Al与NaOH溶液构成的原电池中Al作负极。
[点击试题]
题型1 原电池的判断

题型2 原电池的工作原理
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com