
8.下表是X、Y、Z三种元素的氢化物的某些性质:( )
|
元素 |
熔点/℃ |
沸点/℃ |
与水的反应 |
导电性(纯液体) |
|
X |
-283 |
-162 |
不反应 |
不导电 |
|
Y |
-102 |
19 |
放热反应,形成酸性溶液 |
不导电 |
|
Z |
680 |
/ |
剧烈反应,生成H2,并形成碱性溶液 |
导电 |
若X、Y、Z这三种元素属于周期表中的同一周期,则它们的原子序数递增的顺序是
A.X、Y、Z B.Z、X、Y C.Y、X、Z D.Z、Y、X
7.下列说法错误的是( )
A.原子及其离子的核外电子层数等于该元素所在的周期数
B.元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
C.除氦外的稀有气体原子的最外层电子数都是8
D.同一元素的各种同位素的物质性质、化学性质均相同
6.具有下列结构的原子一定属于碱金属的是( )
A.最外层只有1个电子
B.最外层电子数为次外层电子数的一半
C.M层电子数为K层电子数的一半
D.K、L层电子数之和比M、N层电子数之和大1
5.在两种短周期元素组成的化合物中,它们的原子个数比为1∶2,设两种元素的原子序数分别为a和b,则下列对a和b可能的关系概括得最完全的是( )
①a+b=15 ②a=b+15 ③a=b-5 ④a+b=22
A.①④ B.①③④ C.①②③④ D.①②④
4.已知某元素的阳离子R2+的核内中子数为n,质量数为A,则mg它的氧化物中所含质子的物质的量是( )
A.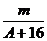 (A-n+8)mol
B.
(A-n+8)mol
B.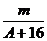 (A-n+10)mol
(A-n+10)mol
C.(A-n+2)mol
D.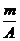 (A-n+6)mol
(A-n+6)mol
3.同主族元素所形成的同一类型的化合物,其结构和性质往往相似,化合物PH4I是一种元素晶体,下列对它的描述中不正确的是( )
A.它是一种共价化合物 B.在加热时此化合物可以分解
C.这种化合物不能跟碱发生反应 D.该化合物可以由PH3跟HI化合而成
2.同周期的X、Y、Z三种元素,已知它们的最高价氧化物对应水化物是HXO4、H2YO4、H3ZO4,则下列判断正确的是( )
A.含氧酸的酸性:H3ZO4>H2YO4>HXO4
B.非金属性:X>Y>Z
C.气态氢化物的稳定性按X、Y、Z顺序由弱到强
D.元素的负化合价的绝对值按X、Y、Z顺序由小到大
1.有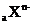 和
和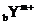 两种离子,其电子层结构相同。下列关系式或化学正确的是( )
两种离子,其电子层结构相同。下列关系式或化学正确的是( )
A.a-n=b+m B.a+m=b-n
C.氧化物为YOm D.氢化物为HnX或XHn
[例6] 周期表中相邻的A、B、C三元素中,A、B同周期,A、C同主族。已知三种元素的原子最外层电子数之和为19,三种元素的原子核中质子数之和为41。则这三种元素是A________、B________、C________(填元素符号)。
[解析] 本题采用平均值法解答比较简单。由A、B、C三元素为相邻元素以及它们的平均质子数41/3≈14<18,可知A、B、C三元素为短周期元素;又根据最外层电子数的平均值19/3≈6.3<7,推知其中必有最外层电子数为7的元素,所以A、B、C三种元素应分布在ⅥA、ⅦA族,经推断A为S,B为Cl、C为O符合题意。
[例7] 已知某主族金属元素X的原子核内质子数和中子数之比为1∶1,含该金属阳离子0.192g的溶液恰好能将20mL 0.4mol/L的Na2CO3溶液中的CO32-全部沉淀,推断X是什么元素及在周期表中的位置。
[解析] 周期表中质子数与中子数相等的金属元素只有Mg和Ca两种,它们都是+2价金属。设金属的相对原子质量为M,由关系式X2+-Na2CO3得,M∶1=0.192∶(0.4×0.02),解得M=24。则X为镁,位于第3周期第ⅡA族。
[例5] X和Y两元素的阳离子具有相同的电子层结构,X元素的阳离子半径大于Y元素的阳离子半径,Z和Y两元素的原子核外电子层数相同,Z元素的原子半径小于Y元素的原子半径。X、Y、Z三种元素原子序数的关系是
A.X>Y>Z B.Y>X>Z C.Z>X>Y D.Z>Y>X
[解析] 对于电子层结构相同的离子,核电荷数越大,半径越小,现X元素的阳离子半径大于Y,故核电荷数应是Y>X。Z和Y的电子层数相同,则它们在同一周期,随着核电荷数的递增,原子半径逐渐减小,现Z的原子半径小于Y,则核电荷数Z>Y。综合以上关系得Z>Y>X。
本题正确答案为D。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com