
15.下列关于核反应的说法中,正确的是 ( )
A.卢瑟福通过对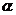 粒子散射实验的现象分析,提出了原子的核式结构模型
粒子散射实验的现象分析,提出了原子的核式结构模型
B.放射性元素原子核的半衰期元素的物理、化学状态无关
C.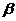 衰变中所放出的电子,来自原子核外内层电子
衰变中所放出的电子,来自原子核外内层电子
D.核电站是利用轻核聚变时质量亏损产生的巨大核能来发电的
14.下列关于光电效应及波粒二象性的叙述中,正确的是 ( )
A.发生光电效应时,光电流的强度与入射光的强度成正比
B.发生光电效应时,光电子的最大初动能与入射光频率成正比
C.光的波长越长,其波动性越显著;波长越短,其粒子性越显著
D.任何一个运动的物体都具有波粒二象性
13.现有10g镁铝合金与足量的稀硫酸充分反应后,共收集到标况下的气体体积11.2L,向反应后的溶液中滴加NaOH溶液至沉淀达最大值,过滤、洗涤、干燥后得沉淀的质量为
( )
A.18.5G B.27g C.21g D.24.5g
12.咖啡酸可用作化学原料和中间体,其结构如图所示。下列关于咖啡酸说法不正确的是
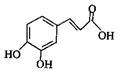 ( )
( )
A.能发生加聚反应
B.能使高锰酸钾溶液褪色
C.1mol咖啡酸最多能与3mol NaOH反应
D.1mol咖啡酸最多能与3mol Br2反应
11.一个完整有氧化还原反应方程式可拆写成两个“半反应式”,呈个是氧化反应式,一个是还原反应式,例如2Fe3++Cu 2Fe2++Cu2+,可以拆成:氧化反应:Cu-2e- Cu2+;还原反应:2Fe3++2e- 2Fe2+,则3NO2+H2O 2H++2NO3-+NO该反应的氧化反应为 ( )
A.2NO2-2e-+2H2O 4H++2NO3-
B.2NO2+2e-+4OH- 2H2O+2NO3-
C.NO2-2e-2H+ H2O+NO
D.NO2+2e-+H2O 2OH-+NO
10.下列反应的离子方程式中正确的是 ( )
A.向碳酸氢钙溶液中加入足量氨水:Ca2++2HCO3-+2OH-
CaCO3↓+CO32-+2H2O
B.次氯酸钙溶液通入过量二氧化硫气体:ClO-+SO2+H2O HClO+HSO3-
C.氯化铝溶液中滴加过量的氨水:Al3++3NH3·H2O Al(OH)3↓+3NH4+
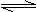 D.硫化钠水解反应:S2-+H3O+ HS-+H2O
D.硫化钠水解反应:S2-+H3O+ HS-+H2O
9.下列热化学方程式正确的是 ( )
A.甲烷的燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g) CO2(g)+2H2O(g):△H=-890.3kJ·mol-1
 B.500℃、30MPa下,将0.5monN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) NH3(g)△H=-38.6 kJ·mol-1
B.500℃、30MPa下,将0.5monN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) NH3(g)△H=-38.6 kJ·mol-1
C.OH-+H+ H2O(1);△H=-57.3
kJ·mol-1(中和热)
D.S(s)+O2(g) SO2(g);△H=-36.9.8
kJ·mol-1(燃烧热)
8.能在溶液中大量共存的一组离子是 ( )
A.NH4+、Ag+、PO43-、Cl- B.Fe3+、H+、I-、SO42-
C.K+、Na+、NO3-、MnO4- D.Al3+、Mg2+、HCO3-、Cl-
7.设NA代表阿伏加德罗常数,下列叙述正确的是 ( )
A.10 mL质量分数为98%的H2SO4,用水稀释至100 rnL,H2SO4的质量分数为9.8%
B.在H2O2+C12 2HCl+O2反应中,每生成32g氧气,则转移电子NA个
C.标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g
D.一定温度下,1 L 0.50mol/L NH4Cl溶液与2 L 0.25 mol·L-1NH4Cl溶液含NH4+数均为0.5 NA
6.我国成功研发出133Cs原子钟,使我国时间频率基准的精度从30万年不差一秒提高到600万年不差一秒,标志着我国在此领域进入世界先进行列,已知133Cs的质子数为55。下列说法正确的是 ( )
A.133Cs的核电荷数为133
B.133Cs原子核内中子数与原子核外电子数之差为23
C.133Cs原子质量与12C原子质量之比为133:6
D.将一小块铯投入水中,铯浮在水面上四处游动,发出嘶嘶的响声
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com