
①强酸弱碱盐的水解:溶液呈酸性,弱碱阳离子水解
②强碱弱酸盐的水解:溶液呈碱性,弱酸根离子水解
③弱酸弱碱盐的水解程度很大,溶液的酸碱性决定与酸碱性的相对强弱
Ⅰ.酸强于碱显酸性,如(NH4)2SO3
Ⅱ.碱强于酸显碱性,如NH4CN
Ⅲ.酸碱强弱相当的呈中性,如CH3COONH4
④强酸强碱盐,不水解,呈中性
⑤弱酸的酸式盐水解,酸取决于酸根离子的电离程度和水解程度的相对大小
Ⅰ如电离程度大于水解程度,以电离为主,溶液呈酸性,如NaHSO3、NaH2PO4
Ⅱ如水解程度大于电离程度,以水解为主,溶液呈碱性,如NaHCO3、Na2HPO4、NaHS
⑥完全双水解的盐,如Al3+与HCO3-、CO32-、S2-、AlO2-等发生双水解进行到底。
①多元弱酸根离子水解,以第一步为主;
②多元弱碱阳离子可书写一步总反应方程式;
③水解程度一般很小,故方程式用“ ”符号,且产生的物质的浓度太小,一般不用“↑”、“↓”表示;
”符号,且产生的物质的浓度太小,一般不用“↑”、“↓”表示;
④双水解比单水解程度大,有些可以进行到底。
⑴概念: 。
⑵实质: 。
⑶盐类水解的规律 。
如果要判断盐类是否发生水解反应或水解后溶液的酸碱性,要看盐的离子对应的酸或碱的相对强弱。
①在通常情况下,盐类水解的程度是很小的,并且反应前后均有弱电解质存在,因而盐的水解反应是可逆的。
②有弱才水解,谁弱谁水解,谁强显谁性,越弱越水解,都弱都水解,两强不水解。
③盐对应的酸(或碱)越弱,水解程度越大,溶液的碱性(或酸性)越强。
④多元弱酸根离子,正酸根离子比酸式酸根离子水解程度大很多。
⑷影响盐类水解的因素:决定因素是盐的结构和性质。
①温度:盐类水解是吸热,升温,水解程度增大。
②浓度:水解过程是一个微粒总量(不考虑水分子)增加的过程,因而加水稀释,平衡向右移动,水解程度加大,而水解产生的H+(或OH-)的浓度减小。
③加入酸、碱等物质:水解显酸性的盐溶液中加入碱,肯定促进盐的水解,加入酸,抑制盐的水解;水解显碱性的同理。总之水解平衡遵从化学平衡移动原理。
6.在半径为 的圆中,圆心角为周角的
的圆中,圆心角为周角的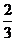 的角所对圆弧的长为
.
的角所对圆弧的长为
.
5.若α=-216°,l=7π,则r= (其中扇形的圆心角为α,弧长为l,半径为r).
4.圆的半径变为原来的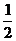 ,而弧长不变,则该弧所对的圆心角是原来
,而弧长不变,则该弧所对的圆心角是原来
的 倍.
3.一个半径为R的扇形,它的周长是4R,则这个扇形所含弓形的面积是( )

2.时钟经过一小时,时针转过了( )
A. 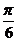 rad
B.-
rad
B.-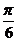 rad
C.
rad
C. 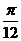 rad D.-
rad D.-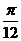 rad
rad
1.圆的半径变为原来的2倍,而弧长也增加到原来的2倍,则( )
A.扇形的面积不变 B.扇形的圆心角不变
C.扇形的面积增大到原来的2倍 D.扇形的圆心角增大到原来的2倍
例1.求图中公路弯道处弧AB的长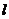 (精确到1m)图中长度单位为:m
(精确到1m)图中长度单位为:m
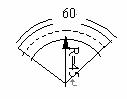 解: ∵
解: ∵ 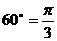
∴ 
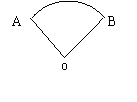
例2.已知扇形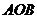 的周长是6cm,该扇形的中心角是1弧度,求该扇形的面积
的周长是6cm,该扇形的中心角是1弧度,求该扇形的面积
解:设扇形的半径为r,弧长为 ,则有
,则有
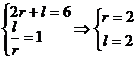
∴ 扇形的面积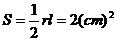
例3 计算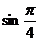 和
和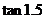
解:∵ 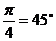 ∴
∴ 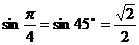
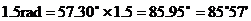
∴ 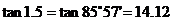
例4 将下列各角化成0到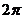 的角加上
的角加上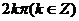 的形式
的形式
⑴ 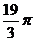 ⑵
⑵ 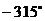
解: 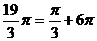
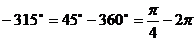
例5 直径为20cm的圆中,求下列各圆心所对的弧长 ⑴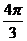 ⑵
⑵ 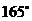
解: 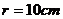 ⑴
⑴ 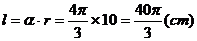
⑵ 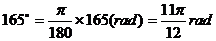 ∴
∴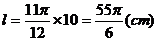
例6 已知扇形周长为10cm,面积为6cm2,求扇形中心角的弧度数.
解:设扇形中心角的弧度数为α(0<α<2π),弧长为l,半径为r,
由题意: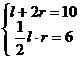
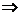
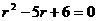
∴ 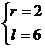 或
或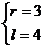 ∴
∴ 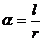 =3 或
=3 或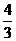
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com