
3.若球的大圆面积扩大为原来的 倍,则球的体积比原来增加 倍;
倍,则球的体积比原来增加 倍;
1 ?球的大圆面积增大为原来的
?球的大圆面积增大为原来的 倍,则体积增大为原来的 倍;
倍,则体积增大为原来的 倍;
2.三个球的半径之比为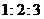 ,那么最大的球的体积是其余两个球的体积和的 倍;
,那么最大的球的体积是其余两个球的体积和的 倍;
例1  有一种空心钢球,质量为
有一种空心钢球,质量为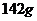 ,测得外径等于
,测得外径等于
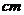 ,求它的内径(钢的密度为
,求它的内径(钢的密度为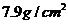 ,精确到
,精确到 ).
).
解:设空心球内径(直径)为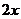
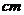 ,
,
则钢球质量为 ,
,
∴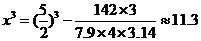 ,
,
∴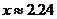 ,∴直径
,∴直径 ,
,
答:空心钢球的内径约为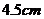 .
.
 1
1  半球的底面:
半球的底面:
已知半径为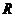 的球
的球 ,用过球心的平面去截球
,用过球心的平面去截球 ,球被截面分成大小相等的两个半球,截面圆
,球被截面分成大小相等的两个半球,截面圆 (包含它内部的点),叫做所得半球的底面
(包含它内部的点),叫做所得半球的底面
2.球的体积:
如图,把垂直于底面的半径 作
作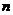 等分,经过这些等分点,用一组平行于底面的平面把半球切割成
等分,经过这些等分点,用一组平行于底面的平面把半球切割成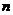 层,每一层都近似于一个圆柱形的“薄圆片”,这些“薄圆片”的体积之和就是半球的体积
层,每一层都近似于一个圆柱形的“薄圆片”,这些“薄圆片”的体积之和就是半球的体积
由于“薄圆片”近似于圆柱形状,它的体积近似于相应的圆柱的体积 圆柱的高就是“薄圆片”的厚度
圆柱的高就是“薄圆片”的厚度 ,底面就是“薄圆片”的下底面
,底面就是“薄圆片”的下底面
 由勾股定理可得,第
由勾股定理可得,第 层(由下向上数),“薄圆片”的下底面半径是
层(由下向上数),“薄圆片”的下底面半径是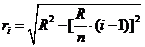 ,
, ,
,
∴第 层“薄圆片”的体积是
层“薄圆片”的体积是
 ,
, ,
,
∴半球体积是
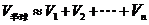
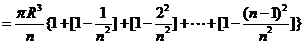

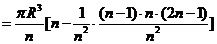
∴半球的体积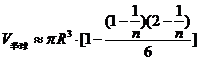 ①
①
容易看出,当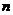 不断变大时,①式越来越精确,若
不断变大时,①式越来越精确,若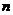 变为无穷大时,
变为无穷大时,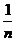 趋向于
趋向于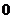 ,
,
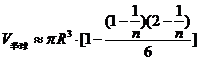
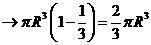
由此,可由①式推出球的体积公式 .
.
4.两点的球面距离:
球面上两点之间的最短距离,就是经过两点的大圆在这两点间的一段劣弧的长度,我们把这个弧长叫做两点的球面距离
3.经度、纬度:
经线:球面上从北极到南极的半个大圆;
纬线:与赤道平面平行的平面截球面所得的小圆;
经度:某地的经度就是经过这点的经线与地轴确定的半平面与 经线及轴确定的半平面所成的二面角的度数;
经线及轴确定的半平面所成的二面角的度数;
纬度:某地的纬度就是指过这点的球半径与赤道平面所成角的度数



 1
1  球的概念:
球的概念:
与定点距离等于或小于定长的点的集合,叫做球体,简称球 定点叫球心,定长叫球的半径
定点叫球心,定长叫球的半径 与定点距离等于定长的点的集合叫做球面
与定点距离等于定长的点的集合叫做球面 一个球或球面用表示它的球心的字母表示,例如球
一个球或球面用表示它的球心的字母表示,例如球 .
.
2.球的截面:
 用一平面
用一平面 去截一个球
去截一个球 ,设
,设 是平面
是平面 的垂线段,
的垂线段, 为垂足,且
为垂足,且 ,所得的截面是以球心在截面内的射影为圆心,以
,所得的截面是以球心在截面内的射影为圆心,以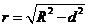 为半径的一个圆,截面是一个圆面
为半径的一个圆,截面是一个圆面
球面被经过球心的平面截得的圆叫做大圆,被不经过球心的平面截得的圆叫做小圆
22、将10gCu粉置于20ml硝酸中,微热,反应过程中,随着硝酸浓度降低,生成的气体颜色由红棕色变浅,共收集到2.016L标况体气(气体由NO、NO2和N2O4组成,其中有0.224L的N2O4),溶液中还残有2.96g固体。
(1)求反应中被还原的硝酸和未被还原的硝酸的物质的量之比(2分)
(2)求该硝酸的物质的量浓度(2分)
(3)求混合气体中NO、NO2的物质的量之比(3分)
江西省莲塘一中2011届高三第一次统考
21.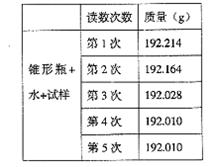 某种含有少量氧化钠的过氧化钠试样(已知试样质量为1.560g、锥形瓶和水的质量为190.720g),利用左图装置测定混合物中Na2O2的质量分数,每隔相同时间读得电子天平的数据如表:
某种含有少量氧化钠的过氧化钠试样(已知试样质量为1.560g、锥形瓶和水的质量为190.720g),利用左图装置测定混合物中Na2O2的质量分数,每隔相同时间读得电子天平的数据如表:

(1)(3分)写出Na2O2和H2O反应的化学方程式
(2)(3分)计算过氧化钠质量分数时,必需的数据是
不必作第6次读数的原因是
(3)(4分)测定上述样品(1.560g)中Na2O2质量分数的另一种方案,其操作流程如下:
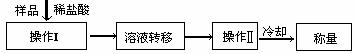
①操作Ⅱ的名称是 ②需直接测定的物理量是
③测定过程中需要的仪器有电子天平、蒸发皿、酒精灯,还需要 、 (固定、夹持仪器除外)
④在转移溶液时,如溶液转移不完全,则Na2O2质量分数的测定结果 (填偏大、偏小或不变)。
20、(8分)少量碘化物的含量可用以下方法进行测定,其步骤如下: ①在中性或弱酸性介质中先用过量的Br2将样品中的I-氧化成IO3-; ②煮沸①所得溶液以除去过量的Br2,然后在酸性条件下加入过量的KI溶液,将IO3- 还原为I2;③在②中加淀粉作指示剂,用Na2S2O3标准溶液滴定(2Na2S2O3+I2=2NaI+Na2S4O6)。 通过上述步骤可测得碘化物中I-的含量。 (1)写出步骤①②中发生反应的离子方程式。
① ② (2)若样品中有1mol I-,则最后耗用Na2S2O3的物质的量是 (3)若在测定时,准确量取含KI的样品溶液25.00mL,终点时耗用0.100mol/LNa2S2O3溶液20.06mL,则样品溶液中KI的含量(g/L)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com