
5、硫酸的工业制法──接触法
4、硫酸
①稀H2SO4具有酸的一般通性,而浓H2SO4具有酸的通性外还具有三大特性:

②SO42-的鉴定(干扰离子可能有:CO32-、SO32-、SiO32-、Ag+、PO43-等):
待测液 澄清液
澄清液 白色沉淀(说明待测液中含有SO42-离子)
白色沉淀(说明待测液中含有SO42-离子)
③硫酸的用途:制过磷酸钙、硫酸铵、硫酸铜、硫酸亚铁、医药、炸药,用于铅蓄电池,作干燥剂、制挥发性酸、作脱水剂和催化剂等。
3、硫的氧化物
(1)二氧化硫:
①SO2是无色而有刺激性气味的有毒气体,密度比空气大,容易液化,易溶于水。
②SO2是酸性氧化物,能跟水反应生成亚硫酸,亚硫酸是中强酸。
③SO2有强还原性 常见氧化剂(见上)均可与SO2发生氧化一还原反应
如:SO2 + Cl 2 +2H2O == H2SO4 + 2HCl
④SO2也有一定的氧化性 2H2S + SO2 == 3S↓ +2H2O
⑤SO2具有漂白性,能跟有色有机化合物生成无色物质(可逆、非氧化还原反应)
⑥实验室制法:Na2SO3 + H2SO4(浓) == Na2SO3 + H2O +SO2↑
或Cu + 2H2SO4(浓)  CuSO4 + 2H2O + SO2↑
CuSO4 + 2H2O + SO2↑
(2)三氧化硫:是一种没有颜色易挥发的晶体;具有酸性氧化物的通性,遇水剧烈反应生成硫酸并放出大量的热。
(3)比较SO2与CO2、SO3
|
|
SO2 |
CO2 |
SO3 |
||
|
主要物性 |
无色、有刺激性气体、易液化易溶于水(1:40) |
无色、无气味气体能溶于水(1:1) |
无色固体.熔点(16.8℃) |
||
|
与水反应 |
 SO2+H2O H2SO3 中强酸 SO2+H2O H2SO3 中强酸 |
 CO2+H2O H2CO2
弱酸 CO2+H2O H2CO2
弱酸 |
SO3+H2O==H2SO4(强酸) |
||
|
与碱反应 |
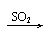 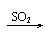 Ca(OH)2 CaSO3↓ Ca(HSO3)2 清液 白 清液 |
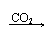 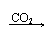 Ca(OH)2 CaCO3↓ Ca(HCO3)2 清液 白↓ 清液 |
SO3+Ca(OH)2==CaSO4(微溶) |
||
|
紫色石蕊 |
变红 |
变红 |
变红 |
||
|
品红 |
褪色 |
不褪色 |
不褪色 |
||
|
鉴定存在 |
能使品红褪色 又能使清石灰变浑浊 |
不能使品红褪色 但能使清石灰水变浑浊 |
|
||
|
氧化性 |
SO2+2H2S=2S↓+2H2O |
 CO2+2Mg
点燃 2MgO+C CO2+2Mg
点燃 2MgO+C
|
|
||
|
还原性 |
有 |
无 |
|
||
|
与Na2O2作用 |
Na2O2+SO2==Na2SO4 |
2Na2O2+2CO2==2Na2CO3+O2 |
2Na2O2+2SO3==2NaSO4+O2↑ |
(4)酸雨的形成和防治
酸雨的形成是一个十分复杂的大气化学和大气物理过程。酸雨中含有硫酸和硝酸等酸性物质,其中又以硫酸为主。从污染源排放出来的SO2、NOx(NO、NO2)是酸雨形成的主要起始物,因为大气中的SO2在光照、烟尘中的金属氧化物等的作用下,经氧化、溶于水等方式形成H2SO4,而NO被空气中氧气氧化为NO2,NO2直接溶于水形成HNO3,造成了雨水pH值降低,便形成了酸雨。
硫酸型酸雨的形成过程为:气相反应:2SO2+O2=2SO3、SO3+H2O=H2SO4;液相反应:SO2+H2O=H2SO3、2H2SO3+O2=2H2SO4。总反应: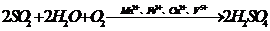
硝酸型酸雨的形成过程为:2NO+O2=2NO2、3NO2+H2O=2HNO3+NO。
引起硫酸型酸雨的SO2人为排放主要是化石燃料的燃烧、工业尾气的排放、土法炼硫等。引起硝酸型酸雨的NOx人为排放主要是机动车尾气排放。
酸雨危害:①直接引起人的呼吸系统疾病;②使土壤酸化,损坏森林;③腐蚀建筑结构、工业装备,电信电缆等。
酸雨防治与各种脱硫技术:要防治酸雨的污染,最根本的途径是减少人为的污染物排放。因此研究煤炭中硫资源的综合开发与利用、采取排烟脱硫技术回收二氧化硫、寻找替代能源、城市煤气化、提高燃煤效率等都是防止和治理酸雨的有效途径。目前比较成熟的方法是各种脱硫技术的应用。
在含硫矿物燃料中加生石灰,及时吸收燃烧过程中产生的SO2,这种方法称为“钙基固硫”,其反应方程式为:SO2+CaO=CaSO3,2CaSO3+O2=2CaSO4;也可采用烟气脱硫技术,用石灰浆液或石灰石在烟气吸收塔内循环,吸收烟气中的SO2,其反应方程式为:SO2+Ca(OH)2=CaSO3+H2O,SO2+CaCO3=CaSO3+CO2,2CaSO3+O2=2CaSO4。在冶金工业的烟道废气中,常混有大量的SO2和CO,它们都是大气的污染物,在773K和催化剂(铝矾土)的作用下,使二者反应可收回大量的硫黄,其反应原理为:SO2+2CO==S+CO2
2、硫的氢化物
①硫化氢的制取:
Fe+H2SO4(稀)=FeSO4+H2S↑(不能用浓H2SO4或硝酸,因为H2S具有强还原性)
--H2S是无色、有臭鸡蛋气味的有毒气体;能溶于水,密度比空气略大。
②硫化氢的化学性质
 A.可燃性: 2H2S+O2
点燃 2S+2H2O(H2S过量)
A.可燃性: 2H2S+O2
点燃 2S+2H2O(H2S过量)
 2H2S+3O2
点燃 2SO2+2H2O(O2过量)
2H2S+3O2
点燃 2SO2+2H2O(O2过量)
B.强还原性:常见氧化剂Cl2、Br2、O2、Fe3+、HNO3、KMnO4等,甚至SO2均可将H2S氧化成S。
C.不稳定性:300℃以上易受热分解
③H2S的水溶液叫氢硫酸,是二元弱酸。
1、硫
(1)物理性质:硫为淡黄色固体;不溶于水,微溶于酒精,易溶于CS2(用于洗去试管壁上的硫);硫有多种同素异形体:如单斜硫、斜方硫、弹性硫等。
(2)化学性质:硫原子最外层6个电子,较易得电子,表现较强的氧化性。
①与金属反应(与变价金属反应,均是金属氧化成低价态)
2Na+S===Na2S (剧烈反应并发生爆炸)
 2Al+3S
2Al+3S Al2S3(制取Al2S3的唯一途径)
Al2S3(制取Al2S3的唯一途径)
 Fe+S △ FeS(黑色)
Fe+S △ FeS(黑色)
 2Cu + S △ Cu2S(黑色)
2Cu + S △ Cu2S(黑色)
②与非金属反应
 S+O2 点燃 SO2
S+O2 点燃 SO2
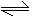 S+H2 △ H2S(说明硫化氢不稳定)
S+H2 △ H2S(说明硫化氢不稳定)
③与化合物的反应
 S+6HNO3(浓) △ H2SO4+6NO2↑+2H2O
S+6HNO3(浓) △ H2SO4+6NO2↑+2H2O
 S+2H2SO4(浓) △ 2SO2↑+2H2O
S+2H2SO4(浓) △ 2SO2↑+2H2O
 3S+6NaOH △ 2Na2S+Na2SO3+3H2O(用热碱溶液清洗硫)
3S+6NaOH △ 2Na2S+Na2SO3+3H2O(用热碱溶液清洗硫)
(3)用途:大量用于制造硫酸、硫化天然橡胶,也用于制药和黑火药。
3、卤素间的置换反应及X-离子的检验:
(1)Cl2 + 2Br- = Br2 + 2Cl-
Cl2 + 2I- = I2 + 2Cl-
Br2 + 2I- = I2 + 2Br-
结论:氧化性:Cl2 > Br2 > I2; 还原性:I- > Br- > Cl-
(2)溴和碘在不同溶剂中所生成溶液(由稀到浓)的颜色变化
 溶剂 溶剂溶质 |
水 |
苯 |
汽 油 |
四氯化碳 |
|
Br2 |
黄
→ 橙 |
橙
→ 橙红 |
橙 → 橙红 |
橙→
橙红 |
|
I2 |
深黄→
褐 |
淡紫 → 紫红 |
淡紫→
紫红 |
紫→
深紫 |
 密
度 密
度 |
|
比 水 轻 |
比 水 轻 |
比 水 重 |
(3)X-离子的检验
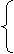 Cl-
白色沉淀
Cl-
白色沉淀
 Br- + AgNO3 +
HNO3
浅黄色沉淀
Br- + AgNO3 +
HNO3
浅黄色沉淀
I- 黄色沉淀
2、卤素元素的有关特性:
(1)F2遇水发生置换反应,生成HF并放出O2。
(2)HF是弱酸、剧毒,但能腐蚀玻璃4HF + SiO2 == SiF4↑ + 2H2O;
HF由于形成分子间氢键相互缔合,沸点反常的高。
(3)溴是唯一的液态非金属,易挥发,少量的液溴保存要用水封。
(4)碘易升华,遇淀粉显蓝色;碘的氧化性较弱,它与变价金属反应时生成低价化合物。
(5)AgX中只有AgF溶于水,且不具有感光性;CaX2中只有CaF2难溶。
1、卤素及化合物的性质比较:
|
|
|
氟 |
氯 |
溴 |
碘 |
|
单质物理性质 |
状态 |
气 |
气(易液化) |
液(易挥发) |
固(易升华) |
|
熔、沸点 |
熔、沸点逐渐升高 |
||||
|
颜色 |
淡黄绿色 |
黄绿色 |
红棕色 |
紫黑色 |
|
|
密度 |
密度逐渐增大 |
||||
|
X2与H2化合 |
条件 |
冷暗处 |
光照 |
加热 |
持续加热 |
|
程度 |
剧烈爆炸 |
爆炸 |
缓慢 |
化合同时分解 |
|
|
X2与H2O化合 |
反应 |
2F2+2H2O=4HF+O2 |
X2 + H2O = HX + HXO |
||
|
程度 |
剧烈 |
缓慢 |
微弱 |
极弱 |
|
|
水溶性 |
|
反应生成氢氟酸 |
水溶性依次减小,有机溶剂中溶解性依次增大 |
||
|
化合价 |
|
只有-1价 |
有-1、+1、+3、+5、+7等 |
||
|
含氧酸 |
化学式 |
无含氧酸 |
有HXO、HXO2、HXO3、HXO4等 |
||
|
强弱程度 |
|
同一价态的酸性依次减弱 |
|||
|
卤化银 |
颜色 |
AgF(白) |
AgCl(白) |
AgBr(淡黄) |
AgI(黄) |
|
水溶性 |
易溶 |
均难溶,且溶解度依次减小 |
|||
|
感光性 |
难分解 |
见光均易分解,且感光性逐渐增强 |
3、氯化氢的实验室制法
(1)药品及反应原理:
NaCl + H2SO4  NaHSO4 + HCl↑ (不加热或微热)
NaHSO4 + HCl↑ (不加热或微热)
NaHSO4 + NaCl  Na2SO4 + HCl↑ (加热到500ºC-600ºC)
Na2SO4 + HCl↑ (加热到500ºC-600ºC)
总式: 2NaCl + H2SO4 Na2SO4 + 2HCl↑
Na2SO4 + 2HCl↑
(2)装置: 与制氯气的装置相似
(3)收集方法: 向上排空气法
(4)检验方法: 用湿润的蓝色石蕊试纸是否变红或用玻璃棒蘸浓氨水靠近是否有白烟产生
(5)尾气处理: 用水吸收(倒扣漏斗)
卤族元素
2、盐酸的化学性质: (挥发性强酸的通性)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com