
5.硝酸(HNO3)
(1)物理性质:无色、刺激性气味、易挥发液体,能与水以任意比例互溶,常用浓硝
酸的质量分数大约为69%。
(2)化学性质:硝酸为强酸,具有以下性质:
|
②浓硝酸不稳定性:4HNO3 = 4NO2↑+ O2↑ + 2H2O
③强氧化性:无论浓稀硝酸均具有强氧化性,与金属反应时不能放出氢气。
a.与金属反应:Cu + 4HNO3(浓)= Cu(NO3)2 + 2NO2↑ + 2H2O ;
3Cu + 8HNO3(稀)= 3Cu(NO3)2 + 2NO↑ + 4H2O;
3Ag + 4HNO3(稀)= 3AgNO3 + NO↑ + 2H2O ;
常温下浓硝酸使铁、铝钝化。
b.与非金属反应:C + 4HNO3(浓)= CO2 ↑+ 4NO2↑ + 2H2O 。
c.与其他还原剂反应,如H2S、SO2、Fe2+等。
d.与有机物反应:硝化反应、酯化反应、与蛋白质发生颜色反应(黄色)等。
(3)制法:
①实验室制法:硝酸盐与浓硫酸微热,
NaNO3(固)+ H2SO4(浓) NaHSO4 +
HNO3↑
NaHSO4 +
HNO3↑
|
②工业制法:氨的催化氧化法,4NH3 + 5O2 = 4NO + 6H2O;
2NO + O2 = 2NO2;
3NO2 + H2O = 2HNO3 + NO;
尾气处理:NO2 + NO + 2NaOH = 2NaNO2 + H2O
4.氮的氧化物
(1)氮的氧化物简介:氮元素有+1、+2、+3、+4、+5五种正价态,对应有六种氧化物
|
种 类 |
色 态 |
化学性质 |
|
N2O |
无色气体 |
较不活泼 |
|
NO |
无色气体 |
活泼,不溶于水 |
|
N2O3(亚硝酸酐) |
无色气体, 蓝色液体(-20℃) |
常温极易分解为NO、NO2 |
|
NO2 |
红棕色气体 |
较活泼,与水反应 |
|
N2O4 |
无色气体 |
较活泼,受热易分解 |
|
N2O5(硝酸酸酐) |
无色固体 |
气态时不稳定,易分解 |
(2)NO和NO2的重要性质和制法①性质:2NO + O2 = 2NO2(易被氧气氧化,无色
气体转化为红棕色);2NO2 (红棕色)
 N2O4(无色)(平衡体系);3NO2 + H2O = 2HNO3
+ NO (工业制硝酸);NO + NO2 + 2NaOH = 2NaNO2 + H2O(尾气吸收); NO2有较强的氧化性,能使湿润的KI淀粉试纸变蓝。②制法:NO: 3Cu +
8HNO3(稀)= 3Cu(NO3)2 + 2NO↑ + 4H2O(必须用排水法收集NO);NO2:Cu
+ 4HNO3(浓)= Cu(NO3)2 + 2NO2↑ + 2H2O (必须用排空气法收集NO2)
N2O4(无色)(平衡体系);3NO2 + H2O = 2HNO3
+ NO (工业制硝酸);NO + NO2 + 2NaOH = 2NaNO2 + H2O(尾气吸收); NO2有较强的氧化性,能使湿润的KI淀粉试纸变蓝。②制法:NO: 3Cu +
8HNO3(稀)= 3Cu(NO3)2 + 2NO↑ + 4H2O(必须用排水法收集NO);NO2:Cu
+ 4HNO3(浓)= Cu(NO3)2 + 2NO2↑ + 2H2O (必须用排空气法收集NO2)
(3)氮的氧化物溶于水的计算:
①NO2或NO2与N2(非O2)的混合气体溶于水可依据3NO2 + H2O = 2HNO3 + NO利用气体体积变化差值进行计算。
②NO2和O2的混合气体溶于水时由4NO2 + O2 + 2H2O = 4HNO3进行计算,当体积比V(NO2):V(O2)=4:1时,恰好反应;>4:1时,NO2过量,剩余NO;<4:1时,O2过量,剩余O2。
③NO和O2同时通入水中时,由4NO + 3O2 + 2H2O = 4HNO3进行计算,原理同②方法。④NO、NO2、O2的混合气体通入水中,先按①求出NO的体积,再加上混合气体中NO的体积再按③方法进行计算。
(4)氮的氧化物(NO、NO2)对环境的影响:
①氮氧化物是形成光化学烟雾和酸雨的一个重要原因,同时也可造成水体污染。汽车尾气中的氮氧化物(燃料在发动机内高温燃烧时,空气中的氮气与氧气反应生成的)与碳氢化合物经紫外线照射发生反应生成形成的一种有毒的烟雾,称为光化学烟雾。光化学烟雾具有特殊气味,刺激眼睛、伤害植物并使大气能见度降低。另外,氮氧化物与空气中的水反应生成硝酸和亚硝酸,是酸雨的成分。大气中氮氧化物主要来源于化石燃料的燃烧、汽车尾气和植物体的焚烧,以及农田土壤和动物排泄物中含氮化合物的转化。因此必须减少氮氧化物的排放,控制进入大气、陆地和海洋的含氮的氧化物。在工业上含氮氧化物的尾气吸收常用以下反应:NO2 + NO + 2NaOH = 2NaNO2 + H2O,既可以回收尾气,生成的亚硝酸盐又是重要的化工原料。
②除人工合成的含氯(如氟利昂)、含溴的物质是造成臭氧层破坏的元凶外,汽车尾气、超音速飞机排出的废气、工业废气等含有大量的氮氧化物(如N0和N02等),也可以破坏掉大量的臭氧分子,从而造成臭氧层的破坏。
3.氮气(N2)
(1)分子结构:电子式为∶N┇┇N∶,结构式为N≡N,氮氮叁键键能大,分子结构稳
定,化学性质不活泼。
(2)物理性质:纯净的氮气是无色无味的气体,难溶于水,空气中约占总体积的78%。
|
|
 2NH3 ②与O2反应: N2 + O2 = 2NO
2NH3 ②与O2反应: N2 + O2 = 2NO
|
(4)氮气的用途:化工原料;液氮是火箭燃烧的推进剂;还可用作医疗、保护气等。
2.铵盐
(1)物理性质:白色晶体,易溶于水
(2)化学性质:①受热分解: NH4HCO3 NH3↑ + H2O + CO2↑
NH3↑ + H2O + CO2↑
NH4Cl NH3↑+ HCl↑
NH3↑+ HCl↑
②与碱反应: NaOH + NH4Cl NaCl + NH3↑ + H2O
NaCl + NH3↑ + H2O
1.氨气(NH3):
(1)分子结构:由极性键形成的三角锥形的极性分子,N原子有一对孤对电子;
(2)物理性质:无色、刺激性气味的气体,密度比空气小,极易溶于水,常温常压下
1体积水能溶解700体积的氨气,易液化(可作致冷剂)
(3)化学性质:
①与H2O反应:NH3
+ H2O  NH3·H2O
NH3·H2O NH4+ + OH-,
NH4+ + OH-,
溶液呈弱碱性,氨水的成份为:NH3 、 H2O、NH3·H2O、NH4+ 、 OH-、H+,氨水易挥发;
②与酸反应:NH3 + HCl = NH4Cl NH3 + HNO3 = NH4NO3 与挥发性酸反应有白烟生成
③还原性(催化氧化):
|
4NH3 + 5O2 = 4NO + 6H2O(N为-3价,最低价态,具有还原性)
(4)实验室制法 Ca(OH)2 + 2NH4Cl CaCl2 +
2NH3↑ + 2H2O,
CaCl2 +
2NH3↑ + 2H2O,
工业㓡法:N2与H2在高温高压催化剂条件下合成氨气
3、比较H2O和H2O2
|
|
H2O |
H2O2 |
|
电子式 |
H: O: H |
H:O:O:H |
|
化学键 |
极性键 |
极性键和非极性键 |
|
分子极性 |
有 |
有 |
|
稳定性 |
 稳定 稳定2H2O 2H2↑+O2↑ |
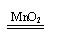 不稳定 不稳定2H2O2 2H2O+O2↑ |
|
氧化性 |
较弱(遇强还原剂反应) 2Na+2H2O==2NaOH+H2↑ |
较强(遇还原剂反应) SO2+H2O2===H2SO4 |
|
还原性 |
较弱 (遇极强氧化剂反应) 2F2+2H2O===4HF+O2 |
较强 (遇较强氧化剂反应) 2MnO4-+5H2O2+6H+==2Mn2++5O2↑+8H2O |
|
作用 |
饮用、溶剂等 |
氧化剂、漂白剂、消毒剂、脱氯剂等 |

H2S+H2SO4(浓) S↓+SO2↑+H2O
S↓+SO2↑+H2O
SO3+2NaHSO3==Na2SO4+2SO2+H2O
3CuSO4  3CuO+2SO2↑+SO3↑+O2↑
3CuO+2SO2↑+SO3↑+O2↑
6FeSO4+3Br2══2Fe2(SO4)3+2FeBr3
2、O2和O3比较
|
|
O2 |
O3 |
|
颜色 |
无色 |
气态-淡蓝色 |
|
气味 |
无 |
刺激性特殊臭味 |
|
水溶性 |
臭氧密度比氧气的大 |
|
|
密度 |
臭氧比氧气易溶于水 |
|
|
氧化性 |
强 (不易氧化Ag、Hg等) |
极强(O3+2KI+H2O==2KOH+I2+O2) (易氧化Ag、Hg等不活泼金属) |
|
漂白性 |
无 |
有(极强氧化性-作消毒剂和脱色剂) |
|
稳定性 |
  3O2
2O3 2O3===3O2 常温:缓慢 3O2
2O3 2O3===3O2 常温:缓慢加热:迅速 |
|
|
相互关系 |
臭氧和氧气是氧的同素异形体 |
1、氧族元素比较: 原子半径 O<S<Se<Te 单质氧化性 O2>S>Se>Te
单质颜色 无色 淡黄色 灰色 银白色 单质状态 气体 固体 固体 固体
氢化物稳定性 H2O>H2S>H2Se>H2Te 沸点 H2O>H2Te>H2Se>H2S(水反常)
最高价含氧酸酸性 H2SO4>H2SeSO4>H2TeO4
2、尾气处理: 氨水 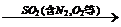 (NH4)2SO3
(NH4)2SO3  (NH4)2SO4+
SO2↑
(NH4)2SO4+
SO2↑
NH4HSO3
氧族元素
1、生产过程:
|
三阶段 |
SO2制取和净化 |
SO2转化为SO3 |
SO3吸收和H2SO4的生成 |
||||
|
三方程 |
2Fe2O3+8SO2 |
2SO2+O2 △ |
SO3+H2O=H2SO4 |
||||
|
三设备 |
沸腾炉 |
接触室 |
吸收塔 |
||||
|
有 关 原 理 |
矿石粉碎,以增大矿石与空气的接触面,加快反应速率 |
逆流原理(热交换器)目的: 冷热气体流向相反,冷的SO2、O2、N2被预热,而热的SO3、SO2、O2、N2被冷却. |
逆流原理(98.3%的浓硫酸从塔顶淋下,气体由下往上,流向相反,充分接触,吸收更完全) |
||||
|
设备中排出的气 体 |
炉气:SO2.N2.O2.矿尘(除尘).砷硒化合物(洗涤). H2O气(干燥)…… 净化气:SO2.N2.O2 |
SO2、O2、N2、SO3 |
尾气:SO2及N2、O2 不能直接排入大气中 |
||||
|
说 明 |
矿尘.杂质:易使催化剂“中毒” H2O气:腐蚀设备、影响生产 |
反应条件-- 理论需要:低温、高压、催化剂;实际应用:400℃-500℃、常压、催化剂 |
实际用98.3%的浓硫酸吸收SO3,以免形成酸雾不利于气体三氧化硫被进一步吸收 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com