
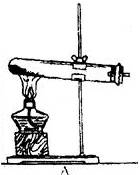
1.气体的发生装置
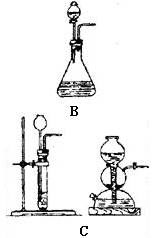
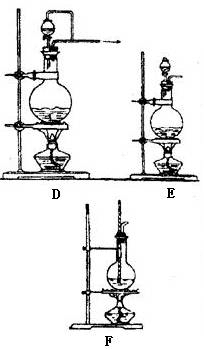
一般根据反应物状态和反应条件设计气体发生装置,通常气体的发生装置有如下几种(见下图)
|
固态反应物加热产生气体 |
有液体反应物不加热产生气体 |
有液体反应物加热产生气体 |
 |
 |
 |
2.一氧化碳:人们常说的煤气中毒就是一氧化碳导致的,它是一种无色无味难溶于水的气体,极易与人体内的血红蛋白结合从而使人缺氧窒息死亡。它是水煤气的成分之一,含碳燃料的不充分燃烧会产生一氧化碳。是一种严重的大气污染物。
1.二氧化碳:
随着工业化程度的提高以及世界范围内人工采伐林木量的增加,森林面积锐减,大气中的二氧化碳浓度逐渐增加。由于二氧化碳对从地表射向太空的长波特别是红外辐射有强烈的吸收作用,从而部分阻碍了地球向太空辐射能量。这就会使地球表面温度升高、两极冰川融化、海平面上升,人们把这种二氧化碳所产生的效应称为温室效应。为了减缓大气中二氧化碳浓度的增加,要控制工业上二氧化碳的排放量并大量植树造林。
6、碳的氧化物对大气的污染
5、常见的无机非金属材料、金属材料与复合材料的比较(表18-7)
|
材料 |
无机非金属材料 |
金属材料 |
复合材料 |
|
涵义 |
以黏土、石英和长石等为原料生产的硅酸盐制品 |
金属及其合金 |
两种或两种以上性质不同的材料经特殊加工而而制成的 |
|
主要成分 |
各种硅酸盐的混合物 |
各种金属及硅等少量非金属 |
由基体(黏结作用)和增强体(骨架作用)组成 |
|
特性 |
抗腐蚀、耐高温、硬度大耐磨损,新型无机非金属材料还具有电学、光学特性、生物功能等 |
强度高、坚韧塑性好、易于成型、有良好的延展性、导电性、导热性,合金抗腐蚀性强 |
耐酸碱、化学稳定性好、密度小、强度高、韧性好、耐高温、导电导热热性能好;性能保持原材料特点又优于原材料 |
|
品种示例 |
玻璃、水泥、各种陶瓷(粘土质陶瓷、高温结构陶瓷、生物陶瓷、压电陶瓷等)、光导纤维 |
黑色金属材料(铁、铬、锰及它们的合金):钢铁;有色金属材料(铁、铬、锰以外的金属及合金):金、银、铜及合金 |
生产生活中的复合材料(玻璃钢:玻璃纤维增强树脂基复合材料、碳纤维:碳纤维增强树脂基复合材料); 航空航天中的复合材料(飞机、火箭:纤维增强金属基复合材料;航天飞机:纤维增强陶瓷基复合材料) |
4.水泥、玻璃和陶瓷等硅酸盐产品的主要化学成分、生产原料及其用途
硅酸盐材料是传统的无机非金属材料:玻璃、水泥、各种陶瓷等都是以黏土、石英和长石等为原料生产的硅酸盐制品,比较如下(表18-6)
|
硅酸盐产品 |
水
泥 |
玻
璃 |
||||||
|
原 料 |
石灰石、黏土 |
纯碱、石灰石、石英 |
||||||
|
反应原理 |
发生复杂的物理化学变化(不作要求) |
SiO2 + Na2CO3 =Na2SiO3 + CO2↑
SiO2 + CaCO3 = CaSiO3 + CO2↑ |
||||||
|
主要设备 |
水泥回转窑 |
玻璃窑 |
||||||
|
主要成分 |
3CaO·SiO2、2CaO·SiO2、3CaO·Al2O3 |
Na2SiO3、CaSiO3、SiO2 |
||||||
|
反应条件 |
高温 |
高温 |
陶瓷生产的一般过程:混合→成型→干燥→烧结→冷却→陶瓷,随着现代科学技术的发展,一些具有特殊结构、特殊功能的新型无机非金属材料如高温结构陶瓷、生物陶瓷、压电陶瓷等相继被生产出来。
3.硅、硅酸及硅酸盐:
(1)硅:单质硅有晶体硅和无定形硅两种。晶体硅为原子晶体,灰黑色、有金属光泽、硬度大而脆、熔沸点高。导电性介于导体和绝缘体之间,是常用的半导体材料。化学性质:①常温Si + 2F2 = SiF4 ;Si + 4HF = SiF4 + 2H2 ;Si + 2NaOH + H2O = Na2SiO3 + 2H2↑
|
|||||
|
|
||||
②加热:Si + O2 = SiO2; Si + 2Cl2 = SiCl4 ;Si + 2H2 = SiH4 。
自然界中无游离态
|
工业上用焦炭在电炉中还原二氧化硅制取粗硅:SiO2 + 2C = Si + 2CO↑
(2)硅酸(H2SiO3或原硅酸H4SiO4):难溶于水的弱酸,酸性比碳酸还弱。
(3)硅酸钠:溶于水,其水溶液俗称“水玻璃”,是一种矿物胶。盛水玻璃的试剂瓶要使用橡胶塞。能与酸性较强的酸反应:Na2SiO3 + 2HCl = H2SiO3↓(白)+ 2NaCl;
Na2SiO3 + CO2 + H2O =H2SiO3↓+ Na2CO3
2.二氧化硅与二氧化碳的对比:
|
物 质 |
二氧化硅 |
二氧化碳 |
||||
|
化学式 |
SiO2 |
CO2 |
||||
|
晶体类型 |
原子晶体 |
分子晶体 |
||||
|
物理性质 |
硬度大、熔沸点高、常温下为固体、不溶于水 |
熔沸点低,常温下为气体,微溶于水 |
||||
|
化 学 性 质 |
①与水反应 |
不反应 |
CO2 +
H2O  H2CO3 H2CO3 |
|||
|
②与酸反应 |
SiO2 + 4HF = SiF4↑+ 2H2O |
不反应 |
||||
|
③与碱反应 |
SiO2 + 2NaOH = Na2SiO3
+ H2O
|
CO2 + 2NaOH = Na2CO3
+ H2O或 CO2 + NaOH = 2NaHCO3 |
||||
|
④与盐反应 |
SiO2 + Na2CO3
=Na2SiO3 + CO2↑
SiO2 + CaCO3 = CaSiO3 + CO2↑ |
Ca(ClO)2
+ CO2 + H2O = CaCO3↓ + 2HClO CO2 + Na2CO3 + H2O = 2NaHCO3 |
||||
|
⑤与碱性氧化物反应 |
SiO2 + CaO = CaSiO3 |
CO2 + Na2O = Na2CO3 |
2.碳的氧化物(CO、CO2)性质的比较:(表18-3)
|
氧化物 |
一氧化碳 |
二氧化碳 |
||
|
物理性质 |
无色无味气体、有毒、难溶于水,能与人体中血红蛋白迅速结合,是一种严重的大气污染物 |
无色略带酸味气体,无毒,能溶于水,固态时俗称“干冰”。 是产生温室效应的气体之一。 |
||
|
化学性质 |
1.
可燃性 2. 还原性:(CuO、Fe2O3、H2O反应) 3. 不成盐氧化物 |
1.
不能燃烧 2. 与C、Mg等反应,表现氧化性 3. 酸性氧化物(与碱反应) |
||
|
实验室制法 |
HCOOH --→ CO↑ + H2O |
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ |
||
|
收集方法 |
排水法 |
向上排空气法 |
||
|
检验方法 |
点燃后在火焰上分别罩上干燥的烧杯和沾有澄清石灰水的烧杯 |
使澄清石灰水变浑浊 |
||
|
用途 |
燃料、化工原料 |
化工原料、灭火等 |
||
|
相互转化 |
C + CO2 = 2CO (高温) 2CO + O2 = 2CO2(点燃) |
1.碳单质:
|
|
|
(2)化学性质:①C + O2 = CO2 ②2C + O2 = 2CO ③C+4HNO3(浓)=CO2↑+ 4NO2↑
|
|
||||
|
|||||
+ 2H2O ④ C + 2CuO = 2Cu + CO2↑⑤ C + CO2 = 2CO ⑥ 2C + SiO2 = Si + 2CO↑
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com