

素,以熔点很高的氧化物及硅酸盐形式存在于岩石、沙子和土壤中,占地壳质量90%以上。位于第3周期,第ⅣA族碳的下方。
Si 对比 C

最外层有4个电子,主要形成四价的化合物。
|
|
碳酸钠 |
碳酸氢钠 |
|
俗名 |
纯碱或苏打 |
小苏打 |
|
色态 |
白色晶体 |
细小白色晶体 |
|
水溶性 |
易溶于水,溶液呈碱性使酚酞变红 |
易溶于水(但比Na2CO3溶解度小)溶液呈碱性(酚酞变浅红) |
|
热稳定性 |
较稳定,受热难分解 |
受热易分解 2NaHCO3 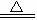 Na2CO3+CO2↑+H2O Na2CO3+CO2↑+H2O |
|
与酸反应 |
CO32-+H+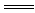 H CO3- H CO3-H CO3-+H+ 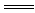 CO2↑+H2O CO2↑+H2O |
H CO3-+H+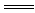 CO2↑+H2O CO2↑+H2O相同条件下放出CO2的速度NaHCO3比Na2CO3快 |
|
与碱反应 |
Na2CO3+Ca(OH)2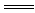 CaCO3↓+2NaOH CaCO3↓+2NaOH反应实质:CO32-与金属阳离子的复分解反应 |
NaHCO3+NaOH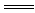 Na2CO3+H2O Na2CO3+H2O反应实质:H CO3-+OH- 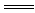 H2O+CO32- H2O+CO32- |
|
与H2O和CO2的反应 |
Na2CO3+CO2+H2O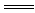 2NaHCO3 2NaHCO3CO32-+H2O+CO2 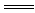 H CO3- H CO3- |
不反应 |
|
与盐反应 |
CaCl2+Na2CO3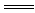 CaCO3↓+2NaCl CaCO3↓+2NaClCa2++CO32- 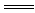 CaCO3↓ CaCO3↓ |
不反应 |
|
主要用途 |
玻璃、造纸、制皂、洗涤 |
发酵、医药、灭火器 |
|
转化关系 |
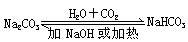 |
A12O3为两性氧化物,Al(OH)3为两性氢氧化物,都既可以与强酸反应生成盐和水,也可以与强碱反应生成盐和水。
金属活动性Na>Mg>Al>Fe。
3、氧化还原反应中概念及其相互关系如下:
失去电子--化合价升高--被氧化(发生氧化反应)--是还原剂(有还原性)
得到电子--化合价降低--被还原(发生还原反应)--是氧化剂(有氧化性)
2、离子反应
(1)、电解质:在水溶液中或熔化状态下能导电的化合物,叫电解质。酸、碱、盐都是电解质。在水溶液中或熔化状态下都不能导电的化合物,叫非电解质。
注意:①电解质、非电解质都是化合物,不同之处是在水溶液中或融化状态下能否导电。②电解质的导电是有条件的:电解质必须在水溶液中或熔化状态下才能导电。③能导电的物质并不全部是电解质:如铜、铝、石墨等。④非金属氧化物(SO2、SO3、CO2)、大部分的有机物为非电解质。
(2)、离子方程式:用实际参加反应的离子符号来表示反应的式子。它不仅表示一个具体的化学反应,而且表示同一类型的离子反应。
复分解反应这类离子反应发生的条件是:生成沉淀、气体或水。书写方法:
写:写出反应的化学方程式
拆:把易溶于水、易电离的物质拆写成离子形式
删:将不参加反应的离子从方程式两端删去
查:查方程式两端原子个数和电荷数是否相等
(3)、离子共存问题
所谓离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
A、结合生成难溶物质的离子不能大量共存:如Ba2+和SO42-、Ag+和Cl-、Ca2+和CO32-、Mg2+和OH-等
B、结合生成气体或易挥发性物质的离子不能大量共存:如H+和C O 32-,HCO3-,SO32-,OH-和NH4+等
C、结合生成难电离物质(水)的离子不能大量共存:如H+和OH-、CH3COO-,OH-和HCO3-等。
D、发生氧化还原反应、水解反应的离子不能大量共存(待学)
注意:题干中的条件:如无色溶液应排除有色离子:Fe2+、Fe3+、Cu2+、MnO4-等离子,酸性(或碱性)则应考虑所给离子组外,还有大量的H+(或OH-)。
(4)离子方程式正误判断(六看)
1、物质之间可以发生各种各样的化学变化,依据一定的标准可以对化学变化进行分类。
(1)根据反应物和生成物的类别以及反应前后物质种类的多少可以分为:
A、化合反应(A+B=AB)B、分解反应(AB=A+B)
C、置换反应(A+BC=AC+B)
D、复分解反应(AB+CD=AD+CB)
(2)根据反应中是否有离子参加可将反应分为:
A、离子反应:有离子参加的一类反应。主要包括复分解反应和有离子参加的氧化还原反应。
B、分子反应(非离子反应)
(3)根据反应中是否有电子转移可将反应分为:
A、氧化还原反应:反应中有电子转移(得失或偏移)的反应
实质:有电子转移(得失或偏移)
特征:反应前后元素的化合价有变化
B、非氧化还原反应
把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系,叫分散系。被分散的物质称作分散质(可以是气体、液体、固体),起容纳分散质作用的物质称作分散剂(可以是气体、液体、固体)。
溶液、胶体、浊液三种分散系的比较
|
|
分散质粒子大小/nm |
外观特征 |
能否通过滤纸 |
有否丁达尔效应 |
实例 |
|
溶液 |
小于1 |
均匀、透明、稳定 |
能 |
没有 |
NaCl、蔗糖溶液 |
|
胶体 |
在1-100之间 |
均匀、有的透明、较稳定 |
能 |
有 |
Fe(OH)3胶体 |
|
浊液 |
大于100 |
不均匀、不透明、不稳定 |
不能 |
没有 |
泥水 |
2.一定物质的量浓度的配制
(1)基本原理:根据欲配制溶液的体积和溶质的物质的量浓度,用有关物质的量浓度计算的方法,求出所需溶质的质量或体积,在容器内将溶质用溶剂稀释为规定的体积,就得欲配制得溶液.
(2)主要操作
a.检验是否漏水.b.配制溶液 1计算.2称量.3溶解.4转移.5洗涤.6定容.7摇匀.8贮存溶液.
1.物质的量浓度.
(1)定义:以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的浓度。(2)单位:mol/L(3)物质的量浓度 = 溶质的物质的量/溶液的体积 CB = nB/V
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com