
2、小说是怎样来描写闰土这个人物的?从哪些方面去对比?请细读课文,搜集信息,完成下边的表格。 (学生完成、课件展示)
对比内容:
外貌: 十一二岁,紫色圆脸,头戴小毡帽,颈上套一个银项圈,有一双红活圆实的手。
中年闰土 脸色灰黄,很深的皱纹,眼睛周围肿得通红,手又粗又笨而且开裂,像是松树皮
动作、语态少年闰土 活泼刚健,动作干脆利落,说话脱口而出,朴质、生动;有智有勇,热情、纯真。 4个省略号(5处对话)说明闰土心里有无穷无尽的希奇的事,说也说不完。
神态说话前的是“欢喜──凄凉──恭敬”说话吞吞吐吐,断断续续,谦恭而又含糊,显得迟钝麻木。
说话后的神态是“只是摇头,脸上虽然刻着许多皱纹,却全然不动,仿佛石像一般”
9个省略号(5处对话)说明闰土心里有说不尽、道不明的苦处。
对我态度 “只是不怕我”,“不到半日,我们便熟识了”,送我贝壳和鸟毛,告诉我很多希奇的事。对“我”友好,热情,和“我”建立了纯真的友情。 恭敬地叫“老爷”,要水生“给老爷磕头”,认为少年时的“哥弟称呼”是“不懂事”,不成“规矩”。和“我”之间隔了一层可悲的厚障壁了。
生活态度 捕鸟、看瓜、刺碴、拾贝、观潮…… ──天真活泼、对生活充满热情和希望。 拣了“一副香炉和烛台”。──将希望寄托于神灵。
1、作者在本文中都写了哪些人呢?本篇小说的主人公是谁?
明确:本文写的人物有闰土、杨二嫂、母亲、水生、宏儿和“我”;闰土就是本文的主要人物, “我”是本文的线索人物。
2、学生展示各自在题目故乡前所加上的所加的定语,并引用文本信息阐释的理由。
预设以下问题,引导学生交流:
1、讨论课文的叙述的线索和小说的结构层次。
(学生发言讨论后明确:小说按以“我”回故乡的见闻和感受为线索展开故事情节的小说,按时间先后为顺序,全文分成三个部分:第一部分(1-5段),写的是故乡的萧条景象,“我”的复杂心情,交代了“我”回故乡的目的;第二部分(6-77段),写“我”在故乡的所见、所闻、所忆、所感,重点写了闰土的变化;第三部分(78-88段)写“我”离开故乡时的种种感触,表达我追求新生活的执著信念。)
2、简介小说创作背景 说说作者及《故乡》创作情况。
鲁迅1898年第一次离开老家绍兴,1919年12月又最后一次回故乡,接母亲来北京居住。《故乡》便是根据这一段生活经历创作出来的。小说中写的人和事是有事实依据的,但又经过了艺术加工,有虚构的成分。作品中的“我”身上有作者的影子,而“我”又不等于就是作者本人。 小说写的是1919年的事,它所反映的却是辛亥革命后十年间中国农村社会的情况。辛亥革命虽然推翻了满清王朝,但中国人民仍处在半殖民地半封建的黑暗社会中,当时,帝国主义加紧对我国进行军事、经济、文化侵略,加上国内军阀混战不休、地主阶级对农民的残酷剥削,使得广大农民陷入困境。作者回乡期间,耳闻目睹了故乡的衰败景象和农民的贫困生活,加之在这个风雨如磐的社会求索了30余年的生活经验,于是写出了悲凉沉郁的《故乡》。
氨气的性质:无色气体,刺激性气味、密度小于空气、极易溶于水(且快)1:700体积比。溶于水发生以下反应使水溶液呈碱性:NH3+H2O
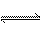 NH3·H2O
NH3·H2O  NH4++OH- 可作红色喷泉实验。生成的一水合氨NH3·H2O是一种弱碱,很不稳定,会分解,受热更不稳定:NH3·H2O
=== NH3 ↑+H2O
NH4++OH- 可作红色喷泉实验。生成的一水合氨NH3·H2O是一种弱碱,很不稳定,会分解,受热更不稳定:NH3·H2O
=== NH3 ↑+H2O
浓氨水易挥发除氨气,有刺激难闻的气味。
氨气能跟酸反应生成铵盐:NH3+HCl == NH4Cl (晶体)
氨是重要的化工产品,氮肥工业、有机合成工业及制造硝酸、铵盐和纯碱都离不开它。氨气容易液化为液氨,液氨气化时吸收大量的热,因此还可以用作制冷剂。
铵盐的性质:易溶于水(很多化肥都是铵盐),受热易分解,放出氨气:
NH4Cl 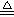 NH3 ↑+HCl ↑
NH3 ↑+HCl ↑
NH4HCO3 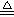 NH3 ↑+H2O ↑+CO2 ↑
NH3 ↑+H2O ↑+CO2 ↑
可以用于实验室制取氨气:(干燥铵盐与和碱固体混合加热)
NH4NO3+NaOH 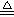 Na NO3+H2O+NH3 ↑
Na NO3+H2O+NH3 ↑
2NH4Cl+Ca(OH)2 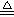 CaCl2+2H2O+2NH3 ↑
CaCl2+2H2O+2NH3 ↑
用向下排空气法收集,红色石蕊试纸检验是否收集满。
小结:SiO2+4HF == SiF4 ↑+2H2O
SiO2+CaO === CaSiO3
SiO2+2NaOH == Na2SiO3+H2O
Na2SiO3+2HCl == H2SiO3+2NaCl
2Na+Cl2 === 2NaCl 2Fe+3Cl2 ===2FeCl3 Cu+Cl2 ===CuCl2 Cl2+H2 === 2HCl
Cl2+H2O=HCl+HClO 2HClO === 2HCl+O2 ↑
Cl2+2NaOH == NaCl+NaClO+H2O
2Cl2+2Ca(OH)2 == CaCl2+Ca(ClO)2+2H2O
HCl+AgNO3 == AgCl ↓+HNO3
NaCl+AgNO3 == AgCl ↓+NaNO3
Na2CO3+2AgNO3 ==Ag2CO3 ↓+2NaNO3
Ag2CO3+2HNO3 == 2AgNO3+CO2 ↑+H2O
Cl-+Ag+ == AgCl ↓
S+O2 === SO2 SO2+H2O  H2SO3
H2SO3
N2+O2 ======== 2NO 2NO+O2 == 2NO2 3 NO2+H2O == 2HNO3+NO
2 SO2+O2  2SO3 SO3+H2O=H2SO4
2SO3 SO3+H2O=H2SO4
2 H2SO4
(浓)+Cu 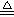 CuSO4+2H2O+SO2 ↑
CuSO4+2H2O+SO2 ↑
2 H2SO4
(浓)+C 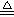 CO2 ↑+2H2O+SO2 ↑
CO2 ↑+2H2O+SO2 ↑
4HNO3(浓)+Cu == Cu(NO3)2+2NO2 ↑+4H2O
8HNO3(稀)+3Cu 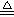 3Cu(NO3)2+2NO ↑+4H2O
3Cu(NO3)2+2NO ↑+4H2O
NH3·H2O
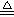 NH3 ↑+H2O NH3+HCl=NH4Cl
NH3 ↑+H2O NH3+HCl=NH4Cl
NH3+H2O  NH3·H2O
NH3·H2O
 NH4++OH-
NH4++OH-
即NH3+H2O  NH4++OH-
NH4++OH-
NH4Cl
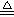 NH3 ↑+HCl ↑
NH3 ↑+HCl ↑
NH4HCO3
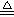 NH3 ↑+H2O ↑+CO2 ↑
NH3 ↑+H2O ↑+CO2 ↑
NH4NO3+NaOH 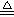 Na NO3+H2O+NH3 ↑
Na NO3+H2O+NH3 ↑
2NH4Cl+Ca(OH)2 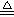 CaCl2+2H2O+2NH3 ↑
CaCl2+2H2O+2NH3 ↑
物理性质:无色液体,易挥发,沸点较低,密度比水大。
化学性质:具有一般酸的通性,浓硝酸和稀硝酸都是强氧化剂。还能氧化排在氢后面的金属,但不放出氢气。
4HNO3(浓)+Cu == Cu(NO3)2+2NO2 ↑+4H2O
8HNO3(稀)+3Cu 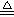 3Cu(NO3)2+2NO ↑+4H2O
3Cu(NO3)2+2NO ↑+4H2O
反应条件不同,硝酸被还原得到的产物不同,可以有以下产物:NO2,HNO2,NO,N2O,N2, NH3△硫酸和硝酸:浓硫酸和浓硝酸都能钝化某些金属(如铁和铝)使表面生成一层致密的氧化保护膜,隔绝内层金属与酸,阻止反应进一步发生。因此,铁铝容器可以盛装冷的浓硫酸和浓硝酸。硝酸和硫酸都是重要的化工原料和实验室必备的重要试剂。可用于制化肥、农药、炸药、染料、盐类等。硫酸还用于精炼石油、金属加工前的酸洗及制取各种挥发性酸。
物理性质:无色粘稠油状液体,不挥发,沸点高,密度比水大。
化学性质:具有酸的通性,浓硫酸具有脱水性、吸水性和强氧化性。是强氧化剂。
C12H22O11 ====== 12C+11H2O放热
2 H2SO4
(浓)+C 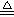 CO2 ↑+2H2O+SO2 ↑
CO2 ↑+2H2O+SO2 ↑
还能氧化排在氢后面的金属,但不放出氢气。
2 H2SO4
(浓)+Cu 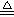 CuSO4+2H2O+SO2 ↑
CuSO4+2H2O+SO2 ↑
稀硫酸:与活泼金属反应放出H2 ,使酸碱指示剂紫色石蕊变红,与某些盐反应,与碱性氧化物反应,与碱中和
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com