
17.(2010·铜川模拟)20℃时,KCl的溶解度为34g,若忽略固体溶解引起的溶液体积变化,则在该温度下,所配KCl溶液的物质的量浓度不可能是( )。
A.5mol/L B.4mol/L C.3mol/L D.2mol/L
[解析]选A。饱和KCl溶液中KCl的物质的量浓度最大。假设将34gKCl固体溶于100g水中,则n(KCl)=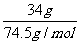 =0.46mol,溶液的体积近似等于水的体积,
=0.46mol,溶液的体积近似等于水的体积,
c(KCl)=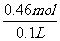 =4.6mol/L。因为不知道溶液是否饱和,所以其物质的量浓度≤4.6mol/L。
=4.6mol/L。因为不知道溶液是否饱和,所以其物质的量浓度≤4.6mol/L。
16.(2010·九江模拟)标准状况下,将VL A气体(摩尔质量为M g·mol-1)溶于0.1L水中,所得溶液密度为ρg·mL-1。则此溶液物质的量浓度为( )。
A.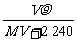 mol·L-1
B.
mol·L-1
B.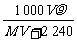 mol·L-1
mol·L-1
C.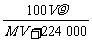 mol·L-1
D.
mol·L-1
D. mol·L-1
mol·L-1
[解析]选B。c= ,n=
,n= mol,溶液质量=(
mol,溶液质量=( ·M+100)g,所以溶液体积=
·M+100)g,所以溶液体积=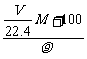 ×10-3L,所以c=
×10-3L,所以c= mol÷(
mol÷(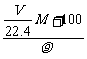 ×10-3)L=
×10-3)L=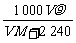 mol·L-1。
mol·L-1。
15.(2010·河池模拟)有五瓶溶液分别是:①10mL0.60mol/LNaOH水溶液 ②20mL0.50mol/LH2SO4水溶液 ③30mL0.40mol/LHCl水溶液 ④40mL0.30mol/LHAc水溶液 ⑤50mL0.20mol/L蔗糖水溶液。以上各瓶溶液所含离子、分子总数的大小顺序是( )。
A.①>②>③>④>⑤ B.②>①>③>④>⑤
C.②>③>④>①>⑤ D.⑤>④>③>②>①
[解析]选D。溶液中的离子.分子总数应包含水分子,因此溶液的体积就决定了离子分子总数的顺序。本题容易错选C,原因都是只考虑了溶质的离子和分子而忽略了溶剂中的水分子,不但丢分,而且计算量不小,浪费了许多宝贵的时间。因此,仔细审题,通盘考虑是关键。
14.(2010·荆州模拟)质量分数不同的两种硫酸溶液等质量混合时,其质量分数为a%,而等体积混合时为b%;质量分数不同的两种乙醇溶液等质量混合时,其质量分数也为a%,而等体积混合时则为c%,则a、b、c之间的大小关系为( )。
A.a>b>c B.b>a>c C.c>a>b D.不能比较
[解析]选B。两种质量分数不同的溶液等质量混合时,混合物中溶质质量分数等于混合前两溶液溶质质量分数之和的一半;等体积相混时,若溶液的密度比水的小,则混合物中溶质质量分数小于混合前两溶液溶质质量分数之和的一半,若溶液的密度比水的大,则混合物中溶质质量分数大于混合前两溶液溶质质量分数之和的一半,硫酸的密度比水的大,乙醇的密度比水的小,所以b>a>c。
13.(2010·安阳模拟)下图为用某浓度的NaOH溶液(Y),滴定10mL某浓度的HCl溶液(X)的图像,据此推断NaOH溶液和HCl溶液的物质的量浓度是( )。
|
|
A |
B |
C |
D |
|
X溶液/mol·L-1 |
0.150 |
0.090 |
0.080 |
0.040 |
|
Y溶液/mol·L-1 |
0.050 |
0.030 |
0.160 |
0.120 |
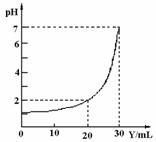
[解析]选B。假设NaOH溶液和HCl溶液的物质的量浓度分别为x和y,由图可知,当加入20mLNaOH溶液时,溶液的pH=2,此时c(H+)=10-2mol/L,则有:0.01L·y-0.02L·x=(0.01L+0.02L)×10-2mol/L;当加入30mLNaOH溶液时,溶液的pH=7,此时恰好完全中和,则有:0.01L·y=0.03L·x,解得:x=0.03mol/L,y=0.09mol/L。
12.(2010·南阳模拟)若以w1和w2分别表示浓度为c1 mol/L和c2 mol/L硫酸的质量分数,已知2w1=w2,则下列推断正确的是(硫酸的密度比纯水的大)( )。
A.2c1=c2 B.2c2=c1 C.c2>2c1 D.c1<c2<2c1
[解析]选C。因为硫酸的密度比纯水的大,其浓度越大,密度也越大,w2>w1,所以ρ2>ρ1, <1,根据c=
<1,根据c= 可得:
可得: =
= =
= <
< ,即c2>2c1。
,即c2>2c1。
11.(2010·海口模拟)把100g某NaOH溶液(密度是1.2g/mL)蒸发浓缩,余下50mL
溶液时,物质的量浓度为8mol/L,原溶液的浓度是( )。
A.8mol/L B.4.8mol/L C.3.3mol/L D.16mol/L
[解析]选B。蒸发浓缩前后,NaOH的物质的量不变。n(NaOH)=8mol/L×0.050L=0.4mol,蒸发浓缩前溶液的体积为:V(NaOH)=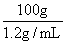 ×
×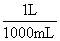 =
= L,所以c(NaOH)=
L,所以c(NaOH)= =4.8mol/L。
=4.8mol/L。
10.(2010·长沙模拟)密度为rg / cm3的溶液VmL,含有相对分子质量为M的溶质mg,其物质的量浓度为cmol/L,质量分数为w%,下列表示式不正确的是( )。
A.c= B.m=
B.m= C.r=
C.r= D.w%=
D.w%= %
%
[解析]选D。A选项是由浓度定义公式得到,B选项可写成m=VmL×rg / cm3×w%,C选项可表示为c=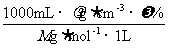 ,D选项应为
,D选项应为 ×100%。
×100%。
1.6gX与Y完全反应后,生成4.4g R,则参与反应的Y和生成物Q的质量比为( )。
A.46∶9 B.32∶9 C.23∶9 D.16∶9
[解析]选D。生成的Q和R质量比为:m(Q)∶m(R)=2M(Q)∶M(R)=(2×9)∶22=9∶11,所以m(Q)=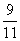 m(R)=
m(R)=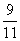 ×4.4g=3.6g。根据质量守恒定律:m(Y)=m(Q)+ m(R)-m(X)=3.6g+4.4g-1.6g=6.4g,所以m(Y)∶m(Q)=6.4g∶3.6g=16∶9。
×4.4g=3.6g。根据质量守恒定律:m(Y)=m(Q)+ m(R)-m(X)=3.6g+4.4g-1.6g=6.4g,所以m(Y)∶m(Q)=6.4g∶3.6g=16∶9。
9.(2010·盐城模拟)已知Q与R的摩尔质量之比为9∶22。在反应X+2Y=2Q+R中,当
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com