
7、(2010·琼海模拟)一定条件下,充分燃烧一定量的丁烷放出热量161.9kJ,经测定完全吸收生成的CO2需消耗5 mol/L的KOH溶液100 ml,恰好生成正盐,则此条件下热化学方程式:C4H10(g) + 13/2 O2(g) → 4CO2(g) + 5 H2O(g)的△H为 ( )
A、+ 2590.4kJ/mol B、-2590.4kJ/mol
C、+ 1295.2kJ/mol D、-1295.2kJ/mol
[解析]选B。据题意,放出161.9kJ热量时生成的CO2的物质的量为5 mol/L×0.1L÷2=0.25 mol,所以△H=-161.9 kJ/mol×16=-2590.4kJ/mol
6、(2010·宁波模拟)已知下列反应的反应热为:
(1)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1=-870.3KJ/mol
(2)C(s)+O2(g)=CO2(g) △H2=-393.5KJ/mol
(3) H2(g)+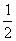 O2(g)=H2O(l)
△H3=-285.8KJ/mol
O2(g)=H2O(l)
△H3=-285.8KJ/mol
试计算下列反应的反应热:( )
2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H
A.-488.3 KJ/mol B. +488.3KJ/mol C. -245.7KJ/mol D. +245.7KJ/mol
[解析]选A。根据盖斯定律,(2)×2+(3)×2-(1)可以得2C(s)+2H2(g)+O2(g)=CH3COOH(l),所以△H=△H2×2+△H3×2-△H1=-488.3 KJ/mol。
5、(2010·湖南师大附中模拟)已知反应:①101kPa时,2C(s)+O2(g)==2CO(g); ΔH=-221 kJ/mol ②稀溶液中,H+(aq)+OHˉ(aq)==H2O(l);ΔH=-57.3 kJ/mol 下列结论正确的是( )
A. ①表示2molC(s)燃烧生成2CO(g)需要吸收221 kJ的热量
B.碳的燃烧热大于110.5 kJ/mol
C.稀硫酸与浓NaOH溶液反应的中和热为-57.3 kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
[答案]B
4、(2010·潍坊模拟)已知通过乙醇制取氢气有如下两条路线:
a.CH3CH2OH(g)+H2O(g)→4H2(g)+2CO(g) △H= +255.6kJ·mol-1
b.CH3CH2OH(g)+1/2O2(g)→3H2(g)+2CO(g) △H= +13.8kJ·mol-1
则下列说法不正确的是( )
A.降低温度,可提高b路线中乙醇的转化率
B.从能量消耗的角度来看,b路线制氢更加有利
C.乙醇可通过淀粉等生物质原料发酵制得,属于可再生资源
D.由a、b知:2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
[解析]选A。b路线中反应为吸热反应,所以降低温度,平衡逆向移动,乙醇的转化率降低。
0.5 mol -121 kJ·mol-1
由上解得 ΔH=-484 kJ·mol-1
设1 mol H-H断裂吸收的热量为Q,则2Q+496 kJ-4×463 kJ=ΔH,故Q=436 kJ。
3、(2010·珠海模拟)已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ。且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O键形成时放出热量463 kJ,则氢气中1molH-H键断裂时吸收热量为( )
A.920 kJ B.557 kJ C.436 kJ D.188 kJ
[解析]选C.本题考查了反应热(焓变的计算方法)。由题意可得
2H2(g)+O2(g)===2H2O(g) ΔH
2 mol ΔH
2、(2010·济南模拟)在怛容条件下化学反应: 2SO2 ( g ) + O2 ( g ) 2SO3( g ) ; △ H =-QkJ·mol-1
在上述条件下分别充入的气体和反应放出的热量 ( Q )如下表所列:
|
容器 |
SO2
(mol) |
O2(mol) |
N2(mol) |
Q(kJ·mol-1) |
|
甲 |
2 |
1 |
0 |
Q1 |
|
乙 |
1 |
0.5 |
0 |
Q2 |
|
丙 |
1 |
0.5 |
1 |
Q3 |
根据以上数据,下列叙述正确的是( )
A.在上述条件下反应生成 lmolSO3固体放热 Q/2 kJ B.2Q1 <2Q2=Q1<Q
C.Ql =2 Q2= 2Q3 = Q D.2Q2 = 2Q3 < Q1 < Q
[解析]选D。2SO2 ( g ) + O2 ( g ) 2SO3( g ) ; △ H =-QkJ·mol-1表示2 mol SO2 ( g ) 和 1 mol
O2 ( g )完全反应生成2 mol SO3( g )时放出QkJ的热量。由于SO3( g )变成SO3( s)要放出热量,所以在上述条件下反应生成 lmolSO3固体放热大于 Q/2 kJ;甲容器中物质不可能完全反应,所以Q1<Q;乙容器中物质不可能完全反应,且相对于甲容器,平衡逆向移动,所以Q2< Q1;丙容器中物质不可能完全反应且与乙容器中物质的转化率相同,所以Q2 = Q3。故有2Q2 = 2Q3 < Q1 < Q。
1、(2010·河南郑州模拟)已知:H2(g)+F2(g)= 2HF(g);△H=-270kJ/mol,下列说法正确的是( )
A.2LHF气体分解成1L的H2和1L的F2吸收270kJ热量
B.1molH2与1molF2反应生成2mol液态HF放出的热量小于270kJ
C.在相同条件下,1molH2与1molF2的能量总和大于2molHF气体的能量
D.1个H2分子与1个F2分子反应生成2个HF分子放出270kJ
[解析]选C。A项,应该是2molHF气体分解吸收270kJ热量;B项,生成液态HF时,放出的热量大于270kJ;D项同A。
⑴制皂过程:
将油脂与 混合煮沸,得到皂化混合液,再向混合液中加入 ,再过滤即可得到高级脂肪酸盐。
[思考] ①所加入的物质的作用是什么?
②由高级脂肪酸钠盐制成的肥皂,称为钠肥皂,又称 ;由高级脂肪酸钾盐制成的肥皂,称为钾肥皂,又称 。
③硬脂酸钠溶液能与 、 反应,生成难溶物,降低肥皂的洗涤效果。
⑵"肥皂"的去污原理
⑶"肥皂"与"合成洗涤剂"的比较
⑷"合成洗涤剂"的优点、缺点及发展方向
试题枚举:
[例1]下列各组中,所含物质不是同系物的是 ( )
A.硬脂酸甘油酯与三乙酸甘油酯 B.油酸与丙烯酸`
C.甘油与软脂酸 D.丙烯酸与软脂酸
解析:硬脂酸与乙酸同为饱和一元酸,故A组为同系物;油酸与丙烯酸同为含一个C=C的一元酸,故B组为同系物;C组中甘油为醇,D组中软脂酸为饱和一元酸
答案:CD
[例2]下列关于油脂的叙述不正确的是 ( )
A.天然油脂没有固定的熔点和沸点
B.油脂是高级脂肪酸和甘油所生成的酯
C.油脂一般易溶于乙醇、苯、氯仿
D.油脂都不能使溴水和酸性高锰酸钾溶液褪色
解析:天然油脂是混合物,所以A正确;B叙述表达了油脂定义的内涵,B正确;油脂易溶于有机溶剂,C正确;油是不饱和脂肪酸的甘油酯,含有不饱和烃基,D错误。
答案:BC
[例3]某天然油脂1g,需0.24gNaOH才能完全皂化,又知该油脂100g完全催化加氢,需H21.2g,则1mol油脂分子中平均含的双键个数为( )
A.6mol B.3mol C.4mol D.5mol
解析:油脂中含有3个酯基,故1mol的油脂皂化时需3mol的NaOH,所以根据题给条件可算出油脂的相对分子质量为500;100克油脂即0.2mol油脂能与0.6mol的H2加成,故1mol油脂分子中含有的双键个数为3mol。
答案:B
[例4]可以判断油脂皂化反应基本完成的现象是( )
A.反应液使红色石蕊试纸变蓝色
B.反应液使蓝色石蕊试纸变红色
C.反应后静置,反应液分为两层
D.反应后静置,反应液不分层
解析:油脂与NaOH溶液未反应前分层,发生完全皂化反应后,生成高级脂肪酸钠盐,甘油和水的混合物,不会出现分层现象,故C错。高级脂肪酸钠为强碱弱酸盐,水解呈碱性,即皂化反应前后反应液均呈碱性,不能依据石蕊试纸变蓝判断反应是否完成,故A、B错。
答案:D
[例5]如果11.5t硬脂酸甘油酯在NaOH溶液中皂化时,仅有85%的硬脂酸甘油酯反应,得到的硬脂酸钠可制成含硬脂酸钠60%的肥皂多少吨?
解析:油脂都是三元酯,所以皂化反应时,1mol硬脂酸甘油酯在NaOH溶液中生成3mol硬脂酸钠。所以,11.5t×85%×3×306÷890÷60%=16.80t
答案:16.80t
⒈油脂的定义: 。
常见的高级脂肪酸有: 、 、 、 。
⒉油脂的结构通式: 。在结构式中,R1,R2,R3相同的称为 ,不相同的称为 。天然油脂通常为 。
[思考]油脂是不是高分子化合物?混甘油酯是混合物吗?
⒊油脂是 和 的合称。 在常温下呈液态,如:植物油。 在常温下呈固态,如:动物油。
⒋油脂的物理性质:
密度比水 ;不溶于 ,易溶于 ;粘度 ;油腻感;好溶剂;熔点 。
⒌油脂的化学性质
油脂是重要的供能物质。油"所含"烃基"的饱和度低,则其熔点低,常温下呈液态。"脂肪"所含"烃基"的饱和度高,则其熔点高,常温下呈固态。所以,可以采用"加氢"的方法,把饱和度低的烃其变成饱和度高的烃基,从而将"油"变"脂肪"。
⑴氢化反应(硬化反应)
写出油酸甘油酯加氢的化学方程式:
应用: 。
⑵水解反应:
①酸性水解:
写出硬脂酸甘油酯酸性水解的方程式:
应用: 。
②碱性水解(皂化反应):
写出硬脂酸甘油酯碱性水解的方程式:
应用: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com