
1.数列极限的定义:
一般地,如果当项数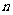 无限增大时,无穷数列
无限增大时,无穷数列 的项
的项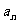 无限趋近于某个常数
无限趋近于某个常数 (即
(即 无限趋近于0),那么就说数列
无限趋近于0),那么就说数列 以
以 为极限,或者说
为极限,或者说 是数列
是数列 的极限.记作
的极限.记作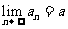 ,读作“当
,读作“当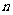 趋向于无穷大时,
趋向于无穷大时,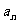 的极限等于
的极限等于 ”
”
“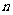
 ∞”表示“
∞”表示“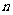 趋向于无穷大”,即
趋向于无穷大”,即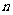 无限增大的意思
无限增大的意思
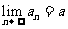 有时也记作:当
有时也记作:当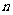
 ∞时,
∞时,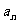

 .
.
理解:数列的极限的直观描述方式的定义,只是对数列变化趋势的定性说明,而不是定量化的定义.“随着项数n的无限增大,数列的项an无限地趋近于某个常数a”的意义有两个方面:一方面,数列的项an趋近于a是在无限过程中进行的,即随着n的增大an越来越接近于a;另一方面,an不是一般地趋近于a,而是“无限”地趋近于a,即|an-a|随n的增大而无限地趋近于0.
2. 观察下列数列,随n变化时,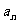 是否趋向于某一个常数:
是否趋向于某一个常数:
(1)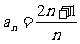 ; (2)
; (2)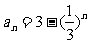 ; (3)an=4·(-1)n-1; (4)an=2n;
; (3)an=4·(-1)n-1; (4)an=2n;
(5)an=3; (6)an=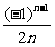 ; (7)an=(
; (7)an=(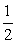 )n; (8)an=6+
)n; (8)an=6+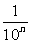
1.战国时代哲学家庄周所著的《庄子·天下篇》引用过一句话:“一尺之棰,日取其半,万世不竭 ”也就是说一根长为一尺的木棒,每天截去一半,这样的过程可以无限制地进行下去
”也就是说一根长为一尺的木棒,每天截去一半,这样的过程可以无限制地进行下去 (1)可以求出第
(1)可以求出第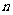 天剩余的木棒长度
天剩余的木棒长度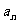 =
=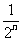 (尺);(2)前
(尺);(2)前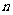 天截下的木棒的总长度
天截下的木棒的总长度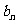 =1-
=1-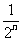 (尺)
(尺) 分析变化趋势.
分析变化趋势.
13、(2010·河北石家庄模拟) 下列五个化学方程式(X、Y、Z均为正值):
①C2H2(g)+H2(g)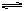 C2H4(g)
C2H4(g)
②CH4(g)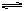 H2(g)+
H2(g)+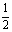 C2H4(g)
C2H4(g)
③C(s)+2H2(g)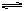 CH4(g); △H= -X kJ·mol-1
CH4(g); △H= -X kJ·mol-1
④C(s)+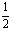 H2(g)
H2(g)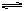
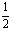 C2H2(g); △H= -Y kJ·mol-1
C2H2(g); △H= -Y kJ·mol-1
⑤C(s)+H2(g)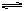
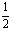 C2H4(g); △H= -ZkJ·mol-1
C2H4(g); △H= -ZkJ·mol-1
当温度下降时①式平衡向右移动,②式平衡向左移动。据此判定③-⑤式中关于X、Y、Z的大小顺序排列正确的是:( )
A.X>Y>Z B.X>Z>Y C.Y>X>Z D.Y>Z>X
[答案]B
()
12、(2010·台州模拟)已知:①2H2(g) + O2(g) = 2H2O(l) △H =-571.6 kJ·mol-1
②H+(aq) + OH-(aq) = H2O(l) △H = -57.3kJ·mol-1。
下列说法中错误的是( )
A.①式表示25℃,101 kPa时,2 mol H2和1 mol O2完全燃烧生成2 mol H2O(l)放热571.6 kJ
B.2H2(g) + O2(g) = 2H2O(g)中△H大于-571.6 kJ·mol-1
C.将含1 mol NaOH的水溶液与50 g 98%的硫酸溶液混合后放出的热量为57.3 kJ
D.将含1 mol NaOH的稀溶液与含1 mol CH3COOH的稀溶液混合后放出的热量小于57.3 kJ
[答案]C。
11、(2010·苏州模拟)1840年,俄国化学家盖斯(G.H.Hess)从大量的实验事实中总结出了一条规律:化学反应不管是一步完成还是分几步完成,其反应热是相同的,即盖斯定律。盖斯定律在生产和科学研究中有很重要的意义,有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。已知3.6 g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出X kJ热量。已知单质碳的燃烧热为Y kJ・mol-1,则1 mol C与O2反应生成CO的反应热ΔH为 ( )
A.-Y kJ・mol-1 B.-(10X-Y)kJ・mol-1
C.-(5X-0.5Y) kJ・mol-1 D.+(10X-Y) kJ・mol-1
[解析]选C。由3.6 g C与6.4 g O2完全反应,可知生成CO2与CO之比为1∶2。设3.6 g C按此方式反应,则生成1 mol CO2和2 mol CO,C单质燃烧热为Y kJ・mol-1,1 mol C与O2生成CO的反应热为:
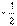 (10X-Y)kJ・mol-1,即-(5X-0.5Y)kJ・mol-1,C正确。
(10X-Y)kJ・mol-1,即-(5X-0.5Y)kJ・mol-1,C正确。
10、(2010·邯郸模拟)2008年北京奥运会“祥云”奥运火炬所用环保型燃料为丙烷(C3H8),悉尼奥运会所用火炬燃料为65%丁烷(C4H10)和35%丙烷,已知:
CO:2CO(g)+O2(g)=2CO2(g);△H=-566.0 kJ/mol。
丙烷:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l);△H=-2221.5 kJ/mol。
正丁烷:C4H10(g)+6.5O2(g)=4CO2(g)+5H2O(l);△H=-2878.0kJ/mol。
异丁烷:C4H10(g)+6.5O2(g)=4CO2(g)+5H2O(l);△H=-2869.6kJ/mol。
下列有关说法正确的是( )
A.常温下,正丁烷的燃烧热为-2878.0kJ/mol
B.相同质量的丙烷和正丁烷分别完全燃烧,前者需要的氧气多,产生的热量也多
C.常温下,CO的燃烧热为566.0 kJ/mol
D.人类利用的能源都是通过化学反应获得的
[解析]选B。A项,常温下,正丁烷的燃烧热应为2878.0kJ/mol;B项,丙烷燃烧时丙烷的质量、产生的热量以及消耗的氧气分别为44 g,2221.5kJ/mol,5 mol,正丁烷燃烧时正丁烷的质量、产生的热量以及消耗的氧气分别为58 g,2878.0 kJ/mol,6.5 mol,所以相同质量的丙烷和正丁烷分别完全燃烧,前者需要的氧气多,产生的热量也多;C项,常温下,CO的燃烧热为283.0 kJ/mol ;D项,人类利用的能源可以不通过化学反应获得,如水力发电、风力发电、太阳能等。
2.2kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为( )
A.Ba2+(aq)+SO42-(aq)=BaSO4(s) △H=-2.92kJ·mol-1
B.Ba2+(aq)+SO42-(aq)=BaSO4(s) △H=-0.72kJ·mol-1
C.Ba2+(aq)+SO42-(aq)=BaSO4(s) △H=-73kJ·mol-1
D.Ba2+(aq)+SO42-(aq)=BaSO4(s) △H=-18kJ·mol-1
[解析]选D。硫酸与氢氧化钡溶液反应的放出的热量为5.12kJ,其中包含2个反应,一个是生成硫酸钡沉淀的反应,一个是生成水的反应,而氢氧化钡与盐酸反应只生成水,放出2.2kJ能量,但是生成水的量是第一个反应的1/2,放出的热量也是第一个反应的1/2,所以硫酸与0.04mol氢氧化钡反应生成0.04mol硫酸钡放出的热量为5.12-2.2×2=0.72kJ。所以生成1mol硫酸钡放出18kJ能量,故答案D正确。
9、(2010·晋中模拟)向足量H2SO4溶液中加入100mL 0.4 mol·L-1 Ba(OH)2溶液,放出的热
量是5.12kJ。如果向足量Ba(OH)2溶液中加入100mL 0.4 mol·L-1 HCl溶液时,放出的热量为
8、(2010·厦门模拟)中科大陈乾旺教授等人发明 合成金刚石的新方法,化学原理为:
合成金刚石的新方法,化学原理为:
① (未配平)
(未配平)
该方法比1955年人工首次制得金刚石的旧方法容易得多,其化学原理是:
②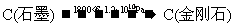 。
。
以下表述正确的是( )
A.反应①中既有旧化学键的断裂又有新化学键的形成
B.新方法利用的是化学变化,旧方法利用的是物理变化
C.在反应①中每生成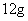 金刚石需要消耗
金刚石需要消耗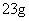 金属钠
金属钠
D.反应①和反应②中所得的金刚石都是还原产物
[解析]选A。B项,新方法和旧方法均发生了化合价的升降,为化学变化;C项方程式配平得8Na+6CO2=C(金刚石)+C(石墨)+4Na2CO3,所以生成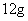 金刚石需要消耗23g×8=184g金属钠;D项②中化合价没有发生变化,所以金刚石不是还原产物。
金刚石需要消耗23g×8=184g金属钠;D项②中化合价没有发生变化,所以金刚石不是还原产物。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com