
5.答案:C
解析:本题考查了几种非金属元素的性质和在周期表中的位置。通常情况下,磷单质为固体,其中白磷分子是由四个磷原子构成的;氧元素可形成多种氢化物,如:H2O和H2O2。故A、B、D都是错误的。
4.答案:A
3.答案:B
解析:溶解过程中伴随有能量的变化,固体硝酸铵溶于水吸热,使温度降低,固体氢氧化钠溶于水放热,使溶液温度升高,生石灰与水反应也放出大量的热,氯化钠溶解过程中能量变化很小。故答案为B。
2.答案:BC
解析:可用极值法解此题。如果仅被还原为+4的氮,所得混合物的平均式量最大,为: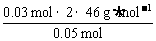 =55.2 g·mol-1;如稀硝酸只被还原为NO,则其式量为30。实质为NO、NO2、N2O4的混合气体,所以其式量介于55.2和30之间。
=55.2 g·mol-1;如稀硝酸只被还原为NO,则其式量为30。实质为NO、NO2、N2O4的混合气体,所以其式量介于55.2和30之间。
1.答案:A
解析:此题利用某元素的相对原子质量是一定值来列式求解。x-62n=y-17n n=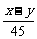 。
。
35.(1994年上海,39)在100 mL NaOH溶液中加入NH4NO3和(NH4)2SO4固体混合物,加热充分反应。下图表示加入的混合物质量和产生的气体体积(标准状况)的关系。试计算
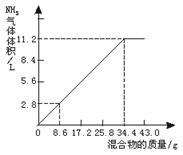
(1)NaOH溶液的物质的量浓度。
(2)当NaOH溶液的体积为140 mL,固体混合物的质量是51.6 g时,充分反应后,生成气体的体积(标准状况)为________ L。
(3)当NaOH溶液的体积为180 mL,固体混合物的质量仍为51.6 g时,充分反应后,生成气体的体积(标准状况)为________ L。
●答案解析
34.(1994年上海,33)(1)红磷放在氯气中燃烧,若P与Cl2按物质的量之比为1∶1.8混合,待充分反应后,生成物中PCl3与PCl5的物质的量之比是________。
(2)在V mL氯化钡溶液中,加入一定体积0.05 mol·L-1的硫酸溶液时,两者恰好完全反应,且反应后溶液的pH为3.0。则原氯化钡溶液的物质的量浓度是________mol·L-1。
注:溶液混合时体积的变化不计。
33.(1995年上海,31)在硝酸生产过程所排放出来的废气中含有NO和NO2,它们污染环境,现有氨催化还原法将它们转化为无毒气体(填名称)________。直接排入空气中,写出有关反应方程式: ,假设NO和NO2物质的量之比恰好为1∶1,则两者的混合物相当于一种酸酐,写出由烧碱溶液吸收这种酸酐的化学方程式: 。
32.(1995年全国,29)一氧化氮是大气污染物之一。目前有一种治理方法是在400℃左右、有催化剂存在的情况下,用氨把一氧化氮还原为氮气和水。请写出该反应的化学方程式 。
31.(1996年上海,31)化合物E(含两种元素)与NH3反应,生成化合物G和H2。化合物G的相对分子质量约为81,G分子中硼元素(B相对原子质量为10.8)和氢元素的质量百分含量分别是40%和7.4%。由此推断:
(1)化合物G的分子式为________;
(2)反应消耗1 mol NH3,可生成2 mol H2,组成化合物E的元素是________和________;
(3)1 mol E和2 mol NH3恰好完全反应,化合物E的分子式为________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com