
4.弹簧振子做简谐运动,周期为T.则
A.t时刻和 t时刻,振子振动的位移大小相等,方向相同,则
t时刻,振子振动的位移大小相等,方向相同,则 一定等于T的整数倍
一定等于T的整数倍
B、t时刻和t+At时刻,振子振动的速度大小相等.方向相反。则 一定等了T/2
一定等了T/2
的整数倍
C、若 =T,则在t时刻和t+
=T,则在t时刻和t+ 时刻振子振动的加速度一定相等
时刻振子振动的加速度一定相等
D、若 t=T/2.则在t时刻t+
t=T/2.则在t时刻t+ 时刻弹簧的长度一定相等
时刻弹簧的长度一定相等
3.两个单摆的摆长之比为1∶2.摆球质量之比为4∶5 最大摆角之比为3∶2.它们在同一地点做简简运动.则它们的频率之比为;
A、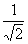 B、
B、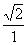 C 、1/4 D 、4/1
C 、1/4 D 、4/1
2.做简谐运动的物体.当其位移为负值时.以下说法正确的是:
A 速度一定为正值,加速度一定为负值
B 速度一定为负值,加速度一定为正值
C 速度不一定为负值,加速度不一定为正值
D 速度不一定为正值,加速度一定为正值
氮、磷及其化合物知识内容丰富,涉及面较广,是历年高考命题的热点之一,试题常以元素及其化合物知识为载体与化学基本概念、基本理论、化学实验及化学计算密切结合。考查的内容主要有:氮气分子的稳定性;氨分子结构与水溶性;铵盐及NH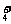 的检验;硝酸的性质;白磷的分子结构;磷酸与碱反应产物的判定;常见磷肥的制备;环境保护等。由于氮族各元素大都能形成多价态的化合物,其中硝酸具有强氧化性,而磷酸是三元酸,可以形成三种盐,使氮磷部分的知识显得较复杂,在高考中占有相当的地位。试题类型主要是选择题、填空题和推断题,以基础题、中档题出现居多。
的检验;硝酸的性质;白磷的分子结构;磷酸与碱反应产物的判定;常见磷肥的制备;环境保护等。由于氮族各元素大都能形成多价态的化合物,其中硝酸具有强氧化性,而磷酸是三元酸,可以形成三种盐,使氮磷部分的知识显得较复杂,在高考中占有相当的地位。试题类型主要是选择题、填空题和推断题,以基础题、中档题出现居多。
氮、磷是生物体中不可缺少的元素,在植物生命活动中占有极其重要的地位,与生物学科知识紧密相连。农业生产中常用氮肥,其生产过程中产生氮的氧化物给环境带来严重的污染,而且大量含氮、磷肥料的生产和使用及工业废水或生活废水的排放,使水体富营养化,形成“赤潮”。氮、磷及其化合物还与人类健康密切相关,1998年获诺贝尔生理学、医学奖的科学家发现一氧化氮是心血管系统中传播信号的分子;磷是人体必需的营养元素,但不可大量饮用含磷饮料,大量饮用有损健康,饮用过多会与血液中的Ca2+作用生成磷酸钙沉淀,可能发生骨质软化和疏松的危险,会造成龋齿。“可乐”饮料中含有少量咖啡因,对呼吸和心脏有兴奋作用。这些与社会实际密切相连的知识内容符合高考理科综合测试要求,将成为“3+X”综合测试的新的热点问题。
[例题]硫酸铵是农村常用的一种铵态氮肥。试回答下列问题:
(1)某硫酸铵肥料,实验测得氮的质量分数为20%,这种样品中可能混有________
A.碳酸氢铵 B.硝酸铵 C.氯化铵 D.磷酸氢二铵
(2)下列物质不能跟硫酸铵肥料混合施用的是________。
A.碳酸氢铵 B.草木灰 C.过磷酸钙 D.氯化钾
(3)田间一次施用该化肥过多会使植物变得枯萎发黄,俗称“烧苗”,其原因是________。
A.根细胞从土壤中吸收的养分过多
B.根细胞不能从土壤中吸水
C.根系不能将水向上运输
D.根系加速了呼吸作用,释放的能量过多
(4)有人给农作物施用15N标记的肥料,结果,在食用此农作物的动物尿中查出15N示踪原子,试问:
①含15N的化肥从土壤溶液中是先后在 和 的过程而进入根细胞的。
②含15N的物质在植物体细胞内的 处合成植物蛋白质。以后动物摄取这种植物的蛋白质,在消化道内,先后经 等酶的作用下,又分解为含15N的氨基酸。
③含15N的氨基酸被吸收进入动物细胞内,又经 作用被分解为含15N的物质,进而转变成 随尿排出体外。
(5)在土地中施用(NH4)2SO4肥料时,植物吸收的NH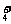 多于SO
多于SO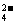 ,会不会造成细胞内酸碱度的不平衡?
,会不会造成细胞内酸碱度的不平衡?
解析:该题是化学和生物相互交叉的综合题。
(1)硫酸铵含氮量为: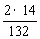 ×100%=21.2%>20%,则必定含有含氮量比20%小的一种化肥,经计算只有NH4HCO3含氮量低于20%。
×100%=21.2%>20%,则必定含有含氮量比20%小的一种化肥,经计算只有NH4HCO3含氮量低于20%。
(2)硫酸铵为铵态氮肥,这种肥料不易跟碱性物质混合使用,因易产生挥发性物质氨气,降低肥效,而草木灰的主要成分为K2CO3,水解会显碱性。
(3)当使用化肥过多时,根细胞不能从土壤中吸水而发黄。
(4)含15N标记肥料经交换吸附,在植物细胞内转化为蛋白质,而蛋白质在动物体内最终转化为尿素排出体外。
答案:(1)A (2)B (3)B
(4)①交换吸附 主动运输 ②核糖体 蛋白酶、肽酶 ③脱氨基 尿素
(5)植物根表面在交换吸附过程中,每吸附一个NH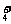 ,就要交换下来一个H+,这种交换是对等的。细胞液中有多种无机盐、有机酸,实际上是一种缓冲溶液;NH
,就要交换下来一个H+,这种交换是对等的。细胞液中有多种无机盐、有机酸,实际上是一种缓冲溶液;NH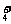 大部分被细胞内生理活动所利用,如合成蛋白质和核酸都需要N元素等。所以,正常情况下植物大量吸收NH
大部分被细胞内生理活动所利用,如合成蛋白质和核酸都需要N元素等。所以,正常情况下植物大量吸收NH 不会造成细胞内酸碱度不平衡。
不会造成细胞内酸碱度不平衡。
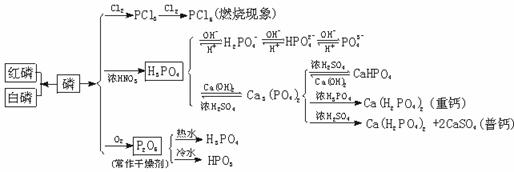
4.磷及其化合物的重要性质
3.氮的氧化物溶于水计算规律
(1)关系式法
①NO2和O2的混合气体溶于水时,由4NO2+O2+2H2O===4HNO3可知,当体积比

②NO和O2同时通入水中时,其反应是:2NO+O2===2NO2,4NO2+O2+2H2O===4HNO3,总式为:4NO+3O2+2H2O===4HNO3
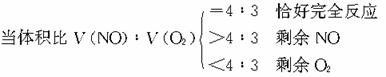
③值得注意的是:4NO2+O2和4NO+3O2从组成上均相当于2N2O5的组成。即(2)(3)两情况中的总反应式都与N2O5+H2O===2HNO3等效。这不仅是记忆①②二式的方法,也为上述问题的解法提供了新的思路。即利用混合气体中的N、O原子个数比进行分析判断:

(2)电子守恒法
当NO2或NO转化为HNO3时要失去电子,若上述两种气体与O2混合,O2得电子,且得失电子数必然相等,这是电子守恒法解答此类题目的依据。
2.分析理解元素化合物性质的方法规律
(1)氮元素的化学活动性与氮分子的稳定性
元素的性质取决于元素的原子结构。氮的原子半径小,吸引电子的能力较强,故表现出较强的化学活动性,所以说氮元素是一种较为活泼的非金属元素。
氮气的稳定性则取决于氮分子的结构。氮分子是由两个氮原子共用三对电子结合而成的,氮分子中有共价三键(N≡N),它的键能很大(946 kJ·mol-1),当氮气参加化学反应时,必须打开(破坏)分子中的三键,这就需要吸收很高的能量。因此,在通常情况下,氮气的性质很不活泼,很难跟其他物质发生化学反应。只有在高温或放电条件下,氮分子获得了足够的能量,使氮分子中的共价键断裂而形成活动性较强的氮原子,才能跟氢气、氧气、金属等物质发生化学反应。
(2)由氨的分子结构分析理解氨的性质:NH3分子为三角锥形,N-H键具有极性,决定了NH3为极性分子,因而氨易液化(易液化的还有SO2、Cl2等);氨极易溶于水,其水溶液的密度小于1;NH3分子也极易与酸反应生成铵盐。
NH3分子中氮元素呈-3价,为氮元素的最低价态,具有还原性,能在一定条件下与O2、Cl2、CuO等反应,被它们氧化:
4NH3+5O2 4NO+6H2O 2NH3+3Cl2===N2+6HCl
4NO+6H2O 2NH3+3Cl2===N2+6HCl
2NH3+3CuO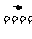 3Cu+N2+3H2O
3Cu+N2+3H2O
(3)关于硝酸性质的分析理解方法
①从属类去分析HNO3具有酸的通性。
②从硝酸中+5价氮元素去分析HNO3具有强氧化性,表现在能与多数金属、非金属、某些还原性化合物起反应。要注意,由于硝酸氧化性很强,任何金属与硝酸反应都不能放出氢气,在与不活泼金属如Cu、Ag等反应时,浓硝酸还原产物为NO2,稀HNO3还原产物为NO,(但不能认为稀HNO3的氧化性比浓硝酸强);在常温下,浓硝酸能使铁、铝等金属钝化;浓硝酸和浓盐酸体积之比为1∶3组成的混合物称为王水,氧化性很强,能氧化一些不溶于硝酸的金属,如:Pt、Au等。
③硝酸不稳定,易分解,受热、光照或浓度越大,硝酸越易分解。由于分解生成的NO2溶于硝酸而使硝酸呈黄色。实验室里为防止硝酸分解,常将硝酸盛放在棕色瓶内,贮放在黑暗而且温度低的地方。
1.氮及其化合物间的转化关系
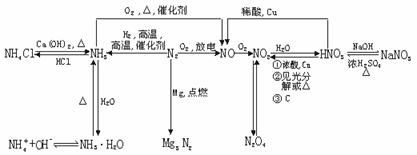
35.答案:(1)5 mol·L-1 (2)15.68 (3)16.8
解析:(1)从图上看出:34.4 g混合物和100 mL NaOH恰好完全反应。
因为1 mol NaOH-1 mol NH3即n(NaOH)=n(NH3)=11.2 L/22.4 L·mol-1=0.5 mol,c(NaOH)=n/V=0.5 mol/0.100 L=5 mol·L-1。
(2)V(NaOH)=140 mL,因为固体过量,
所以V(气)=22.4n(NaOH)=22.4×5×0.140=15.68(L)
(3)V(NaOH)=180 mL,过量,固体51.6 g,由图得出34.4 g/11.2 L=51.6 g/V(气),V(气)=16.8 L。
●命题趋向与应试策略
0.3 0.3 0.3
最终剩余PCl3 1 mol-0.3 mol=0.7 mol,n(PCl5)=0.3 mol。二者的物质的量之比为0.7∶0.3=7∶3。
(2)依题意知c(H+)=10-3 mol·L-1。设BaCl2溶液的摩尔浓度为c,加入H2SO4的体积为x mL,则由反应方程式:
BaCl2+H2SO4===BaSO4↓+2HCl
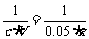 =
= 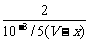
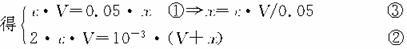
将③代入②解得c=5.05×10-4 mol·L-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com