
13.已知酸式盐NaHB在水溶液中存在下列反应:
①NaHB=Na++HB-,②HB- H++B2-,
H++B2-,
③HB-+H2O H2B+OH-,
H2B+OH-,
且溶液中c(H+)< c(OH-),则下列说法一定正确的是
A、NaHB为强电解质 B、H2B为强酸
C、Na2B溶液pH<7 D、HB-的电离程度小于HB-的水解程度
12.如图所示,杠杆AB两端分别挂有体积相同.质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入M的浓溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑两球的浮力变化)
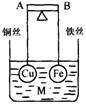 A.当M为盐酸、杠杆为导体时,A端高,B端低
A.当M为盐酸、杠杆为导体时,A端高,B端低
B.当M为CuSO4、杠杆为导体时,A端低,B端高
C.当M为CuSO4、杠杆为绝缘体时,A端低,B端高
D.当M为AgNO3、杠杆为导体时,A端高,B端低
11.在体积都为1L,pH=2的盐酸和醋酸溶液中,投入0.65g锌粒,则下图所示比较符合客观事实的是(醋酸的电离常数K=1.75×10-5)

9.下表是几种物质在不同温度下的溶解度,工业上将等物质的量的NaCl、CO2、NH3溶于适量水中,在30℃时配成溶液,此时溶液无晶体,当降致某温度时,开始析出晶体。此晶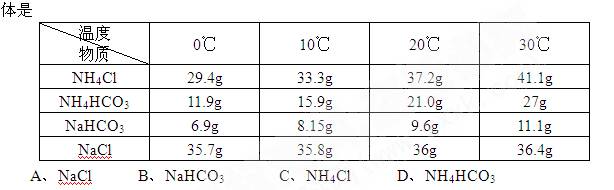 10.下列各种情况下,溶液中能大量存在的离子组是
10.下列各种情况下,溶液中能大量存在的离子组是
A.由水电离出的c(H+)=l×10-12mol/L的溶液中:K+、Ba2+、Cl-、NO3-
B.澄清透明的溶液中:I-、Cl-、ClO-、NH4+
C.使pH试纸呈红色的溶液中:K+、Fe2+、NO3-、MnO4-
D.可溶解铝粉的溶液中:K+、Mg2+、SO32-、SO42-
7. 某可逆反应L(s)+G(g)
某可逆反应L(s)+G(g)  3R(g); △H>0,如图表示外界条件温度、压强的变化对上述反应的影响。试判断图中y轴不可以表示
3R(g); △H>0,如图表示外界条件温度、压强的变化对上述反应的影响。试判断图中y轴不可以表示
A.平衡混合气中R的质量分数
B.达到平衡时G的转化率
C.平衡混合气中G的质量分数
D.达到平衡时L的转化率
 C.电解NaCl水溶液可制得金属钠 D.化合物A可能是分子晶体
C.电解NaCl水溶液可制得金属钠 D.化合物A可能是分子晶体
6.室温下,等体积、都是0.5mol/L的①NaCl ②AlCl3 ③HF ④K2CO3四种物质的水溶液中,所含阳离子数目由少到多的顺序是
A.③①④② B.③①②④ C.①④③② D.④②①③
5.某有机物能使溴水褪色,也能在一定条件下发生水解生成两种有机物,还能发生加聚反应生成高分子化合物,则此有机物中一定含有下列基团的组合是
①-CH3;②-OH;③-Cl;④-CHO;⑤-C2H3;⑥-COOH;⑦-COOCH3
A、③⑤ B、②⑥ C、⑤⑦ D、④⑤
4.下列实验中,仪器的下端必须插入液面下的是
①制备氢气的简易装置中的长颈漏斗 ②制备氯气装置中的分液漏斗
③制备Fe(OH)2操作中的胶头滴管 ④将氯气溶于水时的导管
⑤用乙醇制取乙烯时的温度计 ⑥分馏石油时的温度计
A.①③⑤ B.②④⑥ C.①③④⑤ D.全部
3.原子序数依次增大的A、B、C、D、E五种短周期元素。B、C、D位于同一周期相邻位置,B和D的原子最外层电子数之比为2∶3;B、C、D分别与A形成的化合物分子中都含有10个电子;E的原子结构示意图中从内到外各层的电子数之比为1∶4∶1。则下列叙述中正确的是
A.B和D形成的某种化合物能与E的单质在一定条件下发生置换反应
B.实验室制备A和C两种元素形成的化合物发生的反应属于氧化还原反应
C.由B、D原子或A、B原子构成的分子都是非极性分子
D.由A、B、C、D四种元素组成的化合物中不可能含有离子键
2.下列说法中正确的是
A.由非金属元素组成的化合物一定是共价化合物
B.当NO2溶于水产生1molNO时,反应转移的电子数为6×1023个
C.质子数相同的粒子一定属于同种元素
D.在c(H+)=c(OH-)的溶液中,AlO2-不可能大量存在
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com