
23.(12分)聚合氯化铝晶体[A12(OH)nCl6-n。·H2O]m是介于AlCl3和Al(OH)3之间的一种水溶性无机高分子聚合物,其制备原料主要是铝加工行业的废渣--铝灰,它主要含Al2O3、Al,还有SiO2等杂质。聚合氯化铝生产工艺流程如下:
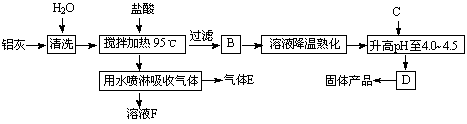
(1)反应中副产品E是 (用化学式表示);
(2)升高pH至4.0-4.5的目的是 ;
(3)生产过程中可循环使用的物质是 (用化学式表示) ;
(4)为使得到的晶体较纯净,生产过程中使pH升高的c物质可选用 (填编号);
a.NaOH b.Al c.氨水 d.A12O3 e.NaAlO2
(5)为测定[A12(OH)nCl6-n。·H2O]m中的n值,进行如下实验:
①称取ag晶体,制成粉末,加热至质量不再变化时,得到bg固体。
②另取a g晶体,进行如下操作:
用A试剂溶解加足量AgNO3溶液操作c烘干称量为c g固体。
操作C为 、 (填操作名称)。
n= (用含a、b、c的代数式表示)。
高州一中2009-2010第二学期高二学科竞赛
22.(12分)已知A、B均是由两种元素组成的化合物,A中某种元素的质量分数为75% ,B是一种淡黄色固体,C、J是同周期元素的气态氢化物,其中C是含氢量最高的烃,X为无色液体。反应生成的水均已略去。它们有如下图所示的关系。
(1)写出化学式:A B J 。
(2)反应③中每生成1molF,转移电子的数目为: 。
(3)反应④的化学方程式为: 。
(4)写出离子方程式分别为:反应② ;
⑤ 。
(5)反应①中,每1.00gC与足量的F作用,恢复到25oC放出55.6kJ热量,写出反应①的热化学方程式 。
21.(14分)现有含烃基R-的有机物R-OH,该物质遇FeCl3溶液显紫色,其蒸气的密度是相同状况下氢气的47倍。工业上ROH可由如下途径获得:

请回答:
(1)反应①的化学方程式为 _____________ _____________________,反应类型_________。
(2)反应②中,每生成 1 mol RONa, 需要消耗NaOH ______ mol 。
(3) 有机物W (C7H8O) 与ROH互为同系物, 任写一种W可能的结构简式_______ 。
(4)已知醇Z 与W互为同分异构体,且Z有如下的转化关系。

经测定,B分子中只含有如下结构片段各1个:
|
RCH2- |
-CH3 |
 |
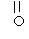 -O-C- -O-C- |
① B 的分子式为 __________ ;
② Z和D 生成A的方程式为:
___________________________________ ;
③ 有机物甲与D“结构相似,分子组成比D多2个CH2原子团”,且分子中除了饱和
烃基与D不同外,其余部分都与D相同。写出甲可能的结构简式:
_______________ 。
20.(10分)化学兴趣组的小张同学在一次实验中,偶然将黑色的四氧化三铁粉末投入到硫酸氢钠溶液中,居然发现硫酸氢钠溶液能溶解四氧化三铁!小张想知道硫酸氢钠溶液中的哪种粒子能使四氧化三铁溶解。请你和他一起通过实验完成这次探究活动。
 (1)小张同学提出的假设是: H2O、H+、Na+、SO42-中的某一种粒子能够使Fe3O4溶解
;
(1)小张同学提出的假设是: H2O、H+、Na+、SO42-中的某一种粒子能够使Fe3O4溶解
;
(2)实验探究过程:如图所示,取若干支装有0.2g四氧化三铁粉末的试管,向其中分别加入某些试剂,观察溶解情况(必要时可加热)。
(3)将有关试剂、现象填入下表(视情况而定,不必填满,不够可另加)。
|
实验 |
① |
② |
③ |
④ |
⑤ |
⑥ |
|
加入试剂 |
|
|
|
|
|
|
|
粉末是否溶解 |
|
|
|
|
|
|
(4)探究结果为: 。
19.(10分)在100℃,将2.00mol的N2O4气体充人4L抽空的密闭容器中,隔一定时间对该容器内的物质进行分析,得到如下表格:
|
时 间/s |
0 |
20 |
40 |
60 |
80 |
|
n(N2O4)/ mol |
2.00 |
c1 |
1.00 |
c3 |
a |
|
n(NO2)/ mol |
0 |
1.20 |
c2 |
2.4 |
2.4 |
(1)在0s-20s内N2O4的平均反应速率为 。
(2)表中c2 c3 a(选填“>”、“<’’或“=”),该反应的平衡常数为 。
(3)若在相同情况下最初向该容器充人的是NO2气体,要达到上述同样的平衡状态, NO2的起始物质的量是 mol。
18.(8分)实验证明:不同浓度的HNO3与同一金属反应可生成不同的还原产物。例如,镁与硝酸反应实验中,测得其气体产物有H2、N2、NO、NO2,溶液中产物有Mg(NO3)2,NH4NO3和H2O。生成这些产物的HNO3浓度范围见下表。
|
生成产物 |
H2 |
N2和NH4+ |
NO |
NO2 |
|
c(HNO3)mol/L |
c<6.6 |
c<10 |
0.1<c<10 |
c>0.1 |
各气体产物成分及含量随HNO3浓度变化曲线如图所示。
(1)若硝酸与镁反应只生成N2气体,则反应的化学方程式为:
____________________________________________________。
(2)1.2g Mg与足量 4mol/L的HNO3完全反应,收集到280 mL(S.T.P)混合气体,其体积分别为H2_______mL、N2_______mL、NO______mL、NO2_______mL。除了上述混合气体外,是否还有其它还原产物? 答: 。(每空1分)
17.(12分)选择合适的化学用语的代号,填写在各小题的横线上。
下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
|
b |
|
|
|||||||||||||||
|
|
|
|
|
h |
|
j |
|
|
|||||||||
|
a |
c |
f |
|
i |
|
l |
m |
||||||||||
|
|
|
|
e |
|
|
|
|
|
|
|
|
|
g |
|
|
|
|
|
|
d |
|
|
|
|
|
|
|
|
|
|
|
|
|
k |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)下列 (填写编号)组元素的单质可能都是电的良导体。
①a、c、h ②b、g、k ③g、m、1 ④d、e、f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
Ⅰ.原子核对核外电子的吸引力 Ⅱ.形成稳定结构的倾向
下表是一些气态原子失去核外不同电子所需的能量(kJ·mol-1):
|
|
锂 |
X |
Y |
|
失去第一个电子 |
519 |
502 |
580 |
|
失去第二个电子 |
7296 |
4570 |
1820 |
|
失去第三个电子 |
11799 |
6920 |
2750 |
|
失去第四个电子 |
|
9550 |
11600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量: 。
②表中X可能为以上13种元素中的 (填写字母)元素。用元素符号表示X和j常温下形成化合物的化学式 。
③Y是周期表中 族元素。
 ④以上13种元素中, (填写字母)元素原子失去核外第一个电子需要的能量最多。
④以上13种元素中, (填写字母)元素原子失去核外第一个电子需要的能量最多。
16.阿伏加德罗常数约为6.02×1023mol-1,下列叙述正确的是
A.2.24LCO2中含有的原子数为0.3×6.02×1023
B.0.1L 3mol·L-1的NH4NO3溶液中含有的NH4+数目一定小于0.3×6.02×1023
C.5.6g铁粉与硝酸反应失去的电子数一定为0.3 ×6.02×1023
D.4.5gSiO2晶体中含有的硅氧键数目为0.3×6.02×1023
第二卷:非选择题
15.下列离子方程式正确的是
A.二氧化氮溶于水:3NO2+H2O=2H++2NO3-+NO
B.将标准状况下112 mL氯气通入10 mL 1 mol·L-1的溴化亚铁溶液中: 2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2
C.次氯酸钙溶液中通入过量二氧化碳: Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO
D.氨水和醋酸溶液混合:NH3·H2O+CH3COOH=NH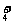 +CH3COO-+H2O
+CH3COO-+H2O
14.自然界中某些矿物的形成过程会发生如下反应:
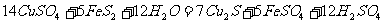 ,下列说法正确的是
,下列说法正确的是
A. FeS2只作还原剂,CuSO4只作氧化剂 B. 5mol FeS2发生反应,有21mol电子转移
C.
产物中的 离子都是氧化产物
D. Cu2S是还原产物
离子都是氧化产物
D. Cu2S是还原产物
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com