
1.(04年广东卷)甲酸和乙酸都是弱酸,当它们的浓度均为0.01mol•L-时,
甲酸中的c(H+)约为乙酸中的3倍。现有两种浓度不等的甲酸溶液a和b,
A.6.9~7.1 B.3.3~10.7 C.4.3~9.7 D.6~8
解题思路: 。
易错点: 。
[例2] 用中和滴定的方法测定NaOH和Na2CO3的混合溶液中NaOH的含量,可
先在混合液中加入过量的BaCl2溶液,使Na2CO3完全变成BaCO3沉淀,然后
用标准盐酸滴定(用酚酞作指示剂).试回答:
(1)滴定时BaCO3能否溶解?理由是
(2)如用甲基橙做指示剂,则测定的结果
解题思路: 。
易错点: 。
【考题再现】
差在±0.1%以内,反应完毕后,溶液的PH范围为( )
[例1] 用0.1mol/LNaOH溶液滴定100ml 0.1mol/L盐酸时,如果滴定误
(9)用含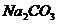 杂质的NaOH固体来配制已知浓度的标准溶液,用于滴定未
杂质的NaOH固体来配制已知浓度的标准溶液,用于滴定未
知浓度的盐酸,使测得盐酸的浓度___________。
(10)洗涤锥形瓶时,误把稀食盐水当做蒸馏水,然后用锥形瓶装待测的盐酸,
用NaOH标准溶液滴定时,对测得的结果______________。
【例题解析】
(8)用含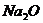 杂质的NaOH固体来配制已知浓度的标准溶液,用于滴定未知
杂质的NaOH固体来配制已知浓度的标准溶液,用于滴定未知
浓度的盐酸,使测得盐酸的浓度___________。
3.分析事例:在中和滴定操作过程中,对于以下各项因操作不当引起的实验误
差,用“偏高”“偏低”或“无影响”等填空:
(1)滴定管用蒸馏水洗净后,未用标准溶液润洗,使滴定结果_ _。
(2)锥形瓶用蒸馏水洗净后,又用待测溶液润洗,使滴定结果___ ______。
(3)标准液滴定管在滴定前尖嘴处有气泡,滴定终了无气泡,结果_______。
(4)滴定前平视,滴定终了俯视,使滴定结果___________。
(5)滴定前仰视,滴定终了平视,使滴定结果____________。
(6)过早估计终点,使滴定结果_______________。
(7)过晚估计终点,使滴定结果_______________,
 2.分析原理:据c标••••••V标••••n标=c待••V待•n待有n待=
。
2.分析原理:据c标••••••V标••••n标=c待••V待•n待有n待=
。
1. 产生误差的因素:(1)标准溶液不标准、(2)仪器洗涤未按要求、(3)滴定
管气泡未排尽、(4)滴定管读数方法不正确、(5)滴定管漏液、(6)终点判断
不准、(7)滴定操作过程和读数过快等
2.滴定:(1)用 移取一定体积的 到 中,加 ,
在瓶底垫 ;
(2)滴定时左手 、右手 、目光注视 。
(3)终点判断:① 、② 、
③ 、④ 。
(4)读数:注意: 。
(5)重复滴定:①目的 、
②当第二次读数与第一次读数误差很小时,是否需要进行第三次滴定
,当第二次读数与第一次读数误差较大时,应该
直到 为止,此时应该取 作为计算标准。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com