
16.(A)11.2g (B)8g (C)33.6g (D)5.6g
6.已知某硫酸、硫酸亚铁、硫酸铁混合液100mL中,各阳离子浓度相等,硫酸根离子总浓
度是6mol·L-1,此溶液中还可溶解的铁粉的质量为
5.将锌、铁、铝、镁四种金属中的两种组成的混合物10g,与足量的盐酸反应产生的氢气在
标准状况下为11.2L,则混合物中一定含有的金属是
(A)锌 (B)铁 (C)铝 (D)镁
4.将铁的化合物溶于盐酸,滴加KSCN溶液不发生颜色变化,再加入适量氯水,溶液立即
呈红色。该化合物是下列物质中
(A)Fe2O3 (B)FeCl3 (C)Fe2(SO4)3 (D)FeO
3.下列物质中,不呈黑色的是
(A)Fe3O4 (B)Fe2O3 (C)Fe(OH)3 (D)FeO
2.红热的铁与水蒸气作用,生成氢气和
(A)氧化亚铁 (B)氧化铁 (C)四氧化三铁 (D)氢氧化铁
1.将铁片投入到下列溶液中不放出气体,并且铁片质量减轻的是
(A)CuSO4 (B)H2SO4 (C)AgNO3 (D) FeCl3
4、Fe2+和Fe3+相互转化:
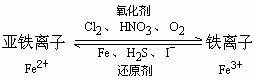
[编织知识网络]写化学方程式:
[例题]
例1、 要证明某溶液中不含Fe3+而可能含有Fe2+进行如下实验操作时最佳顺序为
①加入足量氯水 ②加入足量KMnO4溶液 ③加入少量NH4SCN溶液
A.①③ B.③② C. ③① D. ①②③
思路分析:
加入NH4SCN证明无Fe3+,再加Cl2水,如有Fe2+则可被氧化为Fe3+而使NH4SCN变红色。KMnO4也能氧化Fe2+,但KMnO4本身为紫色,使Fe3+和NH4SCN显色不易观察。
解答:C
例2 、下列物质反应后一定有+3价铁生成的是( )
①过量的Fe与Cl2反应;
②Fe与过量稀H2SO4反应后,再向其中加KNO3;
③Fe(NO3)2溶液中加少量盐酸;
④Fe和Fe2O3的混合物溶于盐酸中。
(A)只有① (B)只有①② (C)只有①②③ (D)全部
分析 : 本题涉及0价铁变为+3价铁、+2价铁变为+3价铁及+3价铁变为+2价铁,应从氧化剂的强弱、反应条件及反应物间的相对量进行分析。
①中的Cl2氧化性强,它能将铁氧化为+3价,由于不是在溶液中反应,因此过量的铁不会将氯化铁还原。
②中Fe与稀H2SO4反应只能生成Fe2+,但要注意,由于稀H2SO4过量,加入KNO3后,H+、 NO3-能将Fe2+氧化成Fe3+。
③从表面上看不会发生复分解反应,实际上也发生了Fe2+被H+和 NO3-氧化的反应。
④中首先发生Fe与盐酸生成FeCl2、Fe2O3与盐酸生成FeCl3的反应,但题中未给出反应物间相对量的关系,若铁是足量的,则能将生成的FeCl3全部还原为FeCl2。
解答:(C)
点拨 铁的0价、+2价、+3价在一定条件下均可相互转化,在分析具体问题时,应善于抓住转化的条件,挖掘出隐含的反应。
例3、 某溶液中有NH4+、Mg2+、Fe2+和Al3+四种离子,若向其中加入过量的NaOH溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是( )
A. NH4+ B.Mg2+ C.Fe2+ D.Al3+
思路分析:以上四种阳离子均能与NaOH反应,生成的产物又都能与盐酸作用。是否能恢复到原状况,分析时请特别注意操作。如果未“微热”,则:
NH4+  NH3·H2O
NH3·H2O  NH4+, NH4+的量并不减少。如果不“搅拌”或隔绝空气的条件下:Fe2+
NH4+, NH4+的量并不减少。如果不“搅拌”或隔绝空气的条件下:Fe2+  Fe(OH)2
Fe(OH)2
 Fe2+
, Fe2+也不会减少。正因为“微热并搅拌”,使NH3·H2O
Fe2+
, Fe2+也不会减少。正因为“微热并搅拌”,使NH3·H2O  NH3↑,Fe(OH)2
NH3↑,Fe(OH)2  Fe(OH)3
Fe(OH)3
 Fe3+,从而使NH4+、Fe2+的量减少。解答:A、C
Fe3+,从而使NH4+、Fe2+的量减少。解答:A、C
[练习]
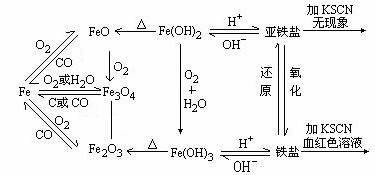
3、Fe2+和Fe3+鉴别
|
|
Fe2+ |
Fe3+ |
|
水溶液颜色 |
浅绿 |
棕黄 |
|
加入NaOH |
Fe2++2OH-==Fe(OH)2↓ 4Fe(OH)2+O2+2H2O==4Fe(OH)3 白 →灰绿 → 红褐色 |
Fe3++3OH-==Fe(OH)3↓ (红褐色) |
|
加入KSCN |
Fe2++2SCN-=Fe(SCN)2 无色 |
Fe3++3SCN-=Fe(SCN)3 血红色 |
|
通入Cl2 |
2Fe2++Cl2=2Fe3++2Cl- |
|
2.关于Fe元素的两种氢氧化物
|
|
Fe(OH)2 |
Fe(OH)3 |
|
|
颜色 |
白 →灰绿 → 红褐色 |
||
|
化学性质 |
①
4Fe(OH)2+O2+6H2O= 4Fe(OH)3 (不稳定) (较稳定) |
||
|
②Fe(OH)2+2H+=Fe2++2H2O |
Fe(OH)3+3H+=Fe3++3H2O |
||
思考:用可溶性碱分别与Fe2+、Fe3+反应可制得Fe(OH)2和Fe(OH)3。实际操作时有何不?通过哪些方法可避免生成Fe(OH)2中会有Fe(OH)3?
提示:关键在于无孔不入的O2及Fe3+存在。
①驱氧法:如用同煮沸过的NaOH溶液
②隔氧法:如用长滴管吸取NaOH溶液后插入亚铁盐溶液面下加入;又如在液面上加某些合适的有机溶剂液封。
③还原法:在FeSO4溶液中加入Fe钉,或者用Fe与稀H2SO4反应新制的FeSO4溶液,生成的H2又可驱赶O2.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com